
科目: 来源: 题型:
【题目】某无色溶液X,由K+、NH4+、Ba2+、Al3+、Fe3+、CO32-、SO42-中的若干离子组成,取该溶液进行如下实验:

(1)白色沉淀甲是___;
(2)试写出实验过程中生成气体A、B的离子方程式___;
(3)通过上述实验,可确定X溶液中一定存在的阴离子是___;尚未确定是否存在的离子是___;
(4)若要检验溶液中是否含有CO32-离子,其方法是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液,为测定甲、乙两瓶溶液的成分及物质的量浓度,进行以下实验:
①量取25.00mL甲溶液,向其中缓慢滴加乙溶液15.00mL,共收集到224mL(标准状况)气体
②量取15.00mL乙溶液,向其中缓慢滴加甲溶液25.00mL,共收集到112mL(标准状况)气体
(1)判断:甲是___溶液,其物质的量浓度为___mol/L;
(2)实验②中所发生反应的离子方程式为___。
Ⅱ.将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物,这些气体恰好能被500mL2.0mol/LNaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,请计算出NaNO3的物质的量___(要求有计算过程与步骤)。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.用98%的浓硫酸(其密度为1.84g/cm3)配制240mL1.0mol/L稀硫酸,若实验仪器有:量筒、烧杯、玻璃棒
(1)需量取浓硫酸的体积为___mL;
(2)实验时还需要的仪器有___;
(3)配制过程中,下列情况会使配制结果偏高的是___(填序号)
①容量瓶使用时未干燥
②定容后经振荡,摇匀,静置,发现液面低于刻度线,再加蒸馏水补至刻度线
③移液后未洗涤烧杯和玻璃棒
④定容时仰视刻度线观察液面
⑤量取浓H2SO4后,用蒸馏水洗涤量筒内壁,并将洗涤液注入烧杯中,一并移液
Ⅱ.请计算28gKOH固体必须溶解在___g水中,才使200个水分子中有1个K+;所得溶液的密度为![]() g/cm3,则该溶液中OH-的物质的量浓度为___(保留到小数点后两位)。
g/cm3,则该溶液中OH-的物质的量浓度为___(保留到小数点后两位)。
查看答案和解析>>
科目: 来源: 题型:
【题目】请按指定要求完成下列问题。
(1)在3BrF3+5H2O=HBrO3+Br2+9HF+O2↑的反应中,3mol的BrF3参加反应时,被水还原的BrF3的物质的量是___。
(2)已知砒霜As2O3与Zn可发生如下反应:As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O
①请用双线桥法标出电子转移的方向和数目___。
②若生成0.2molAsH3,则转移的电子数为___。
(3)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,制备ClO2有以下两种方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
①方法一中氧化剂与还原剂的物质的量之比为___。
②若两种方法制备得到相同条件下相同体积的ClO2气体,则两种方法中消耗的还原剂质量之比是___。
③Cl2与ClO2均用作水处理剂,若它们中的氯元素均被还原为Cl-,则相同质量的ClO2是Cl2消毒效率的___倍(消毒效率:等质量两种物质所转移电子的物质的量之比)。
查看答案和解析>>
科目: 来源: 题型:
【题目】由N、P、S、Cl、Ni等元素组成的新型材料有着广泛的用途,请回答下列问题:
(1)基态N的原子核外___种运动状态不同的电子,基态 P原子核外电子排布式为_____,P、S、Cl的第一电离能由大到小顺序为___。
(2)PCl3分子中的中心原子杂化轨道类型是__,该分子构型为____。
(3)PCl3 是一种无色的液体,遇水容易水解生成两种酸,则方程式__。
(4)已知MgO与NiO的晶体结构(如图)相同, 其中Mg2+和Ni2+的离子半径分别为66 pm和69pm。则熔点:MgO___NiO(填“>”、“<”或“=”),理由是__。
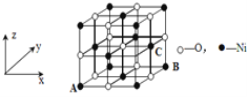
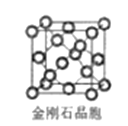
(5)金刚石晶胞含有__个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=___a,列式表示碳原子在晶胞中的空间占有率___(请用r和a表示不要求计算结果)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列是某学生自己总结的一些规律,其中正确的是
A.有的无机化学反应不属于化合、分解、置换、复分解中的任何一种反应
B.某物质在固态时能导电,可确认该物质是金属单质
C.一种元素在同一物质中可显示不同价态,但一定是该元素的相邻价态
D.氧化物只可能是氧化产物,不可能是还原产物
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在2L密闭容器中,起始投入4 molN2和6molH2在一定条件下生成NH3,平衡时仅改变温度测得的数据如表所示(已知:T1<T2)
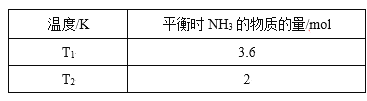
①则K1______K2,(填“>”、“<”或“=”)原因:_______。
②在T2下,经过10s达到化学平衡状态,则0~10s内N2的平均速率v(N2)为______,平衡时H2的转化率为______。若再同时增加各物质的量为1 mol,该反应的平衡V正_____V逆,(>或=或<)平衡常数将_____(填“增大”、“减小”或“不变”)
③下列能说明该反应已达到平衡状态的是___。
A.3v(H2)正=2v(NH3)逆 B.容器内气体压强不变
C.混合气体的平均相对分子质量不再改变的状态 D.△H保持不变
(2)已知下列化学键的键能写出工业上制氨的热化学方程式:
化学键 | H-H | N≡N | N-H |
键能/kJ·mol-1 | 430 | 936 | 390 |
热化学方程式:__________。
(3)下列是科研小组设计的一个氮氧化物原电池,两边的阴影部分为a,b惰性电极,分别用导线与烧杯的m,n(惰性电极)相连接,工作原理示意图如图:
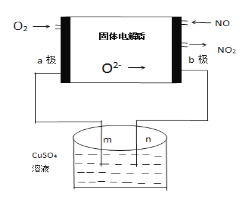
①a为___极,b极的电极反应式____________。
②在标准状况下,通入112mL的O2,可观察到烧杯中n处有_____生成,(假设烧杯中的溶液的体积为200mL,体积不变)最后反应终止时烧杯中溶液的PH为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标况下),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO12.0g,若上述气体为NO和NO2的混合气体,且体积比为1:1,则V可能为( )
A.8.4LB.13.5LC.10.7LD.16.8L
查看答案和解析>>
科目: 来源: 题型:
【题目】以铝土矿(主要成分为Al2O3,含SiO2和铁的氧化物等杂质)为原料制备铝与硫酸亚铁,工艺流程如图所示:请回答下列问题:
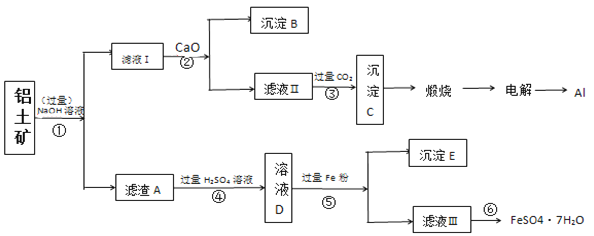
(1)步骤①中提高碱浸速率的方法_______。
(2)滤液Ⅰ中主要的阴离子是______,沉淀B的化学式____,步骤③的离子方程式:____。
(3)步骤⑤加入过量的铁粉的目的___(用离子方程式解释)
(4)检验滤液Ⅲ中的金属阳离子的方法是:_____。
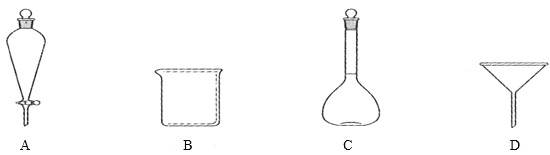
(5)滤液Ⅲ经过________,_______,过滤得到硫酸亚铁晶体,过滤时需要的玻璃仪器有___(填标号)。
(6)利用上述工艺流程测定铝土矿中铁元素的质量分数,取10g样品,最终得到5.56g的FeSO4·7H2O晶体,该铝土矿中铁元素的质量分数_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】若阿伏加德罗常数的数值用NA表示,下列说法正确的是( )
A.1.6gNH2-离子所含质子数为NA
B.常温常压下,200g8.5%的H2O2溶液中含氧原子数为NA
C.7.8gNa2O2晶体中所含离子总数为0.4NA
D.在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com