
科目: 来源: 题型:
【题目】测定 0.1 mol/LNa2SO3溶液先升温再降温过程中的 pH ,数据如下。

实验过程中,取①、④时刻的溶液,加入盐酸酸化的 BaCl2 溶液做对比实验,④产生白色沉淀多。下列说法不正确的是( )
A. 此实验中 Na2SO3溶液的 pH 是由 pH 计测定的
B. ④与①的 PH 不同,是由于 SO32—浓度减小造成的
C. ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D. ①与④的 KW值相等
查看答案和解析>>
科目: 来源: 题型:
【题目】一般较强酸可制取较弱酸,这是复分解反应的规律之一。已知在常温下测得浓度均为0.1mol/L的下列 3 种溶液的 pH:
溶质 | NaHCO3 | Na2CO3 | NaClO |
pH | 8.34 | 11.6 | 10.3 |
下列有关说法正确的是( )
A. 以上溶液的 pH 是用广泛 pH 试纸测定的
B. 反应CO2+H2O+2NaClO=Na2CO3+2HClO可以发生
C. 室温下,电离常数: K2( H2CO3)>K( HClO)
D. 在新制氯水中加入少量 NaHCO3固体可以提高溶液中 HClO 的浓度
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与人类文明进步息息相关,下列说法错误的是( )
A. 蚕丝的主要成分是蛋白质,属于天然高分子材料
B. 汉代烧制出“明如镜、声如磬”的瓷器,主要化学成分是硅酸盐
C. 2022年冬奥会聚氨酯速滑服,是无机非金属材料
D. 城市公交系统推广的清洁燃料压缩天然气“![]() ”、液化石油气“
”、液化石油气“![]() ”,主要成分都是烃
”,主要成分都是烃
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学称取一定质量的MgCl2固体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液(如下图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如下图乙所示。

请回答下列问题:
(1)溶解MgCl2固体所用的玻璃仪器有______(填字母)。
a.天平 b.烧杯
c.漏斗 d.玻璃棒
(2)OA段反应的离子方程式为______________________________________。
(3)AB段反应的离子方程式为______________________________________。
(4)在B点对应的溶液中滴加AgNO3溶液,观察到的现象是________,反应的离子方程式为_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,有浓度均为 0.1mol/L、体积均为 100mL 的两种一元酸HX、HY溶液,下列叙述不正确的是()
A. 若此时 HY 溶液的 pH=3,则 HY 是弱酸
B. 若分别加入 0.01molNaOH 固体,则酸碱恰好完全中和
C. 若分别加入 0.01molNaOH 固体,则所得溶液的pH 均为 7
D. 若此时 HX 溶液的 pH=1,则由水电离出的c(H+) =1×10-13 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,如图是海水综合利用的一个方面。
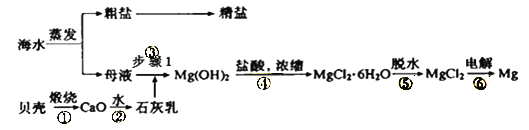
I.(1)上述过程中没有涉及到的四大基本反应类型是___;
a.化合反应 b.分解反应 c.置换反应 d.复分解反应
(2)步骤③中分离操作的名称是___;
II.实验室需要480mL2.0mol·L-1NaCl溶液。
(3)除烧杯和玻璃棒、胶头滴管外,还需要的玻璃仪器有___;
(4)配制时,按以下几个步骤进行:①计算 ②称量 ③溶解 ④冷却 ⑤转移 ⑥定容 ⑦摇匀 ⑧装瓶。操作中还缺少一个重要步骤是___;
(5)下列错误操作可使所配制氯化钠溶液浓度偏低的是___。
a.容量瓶洗净后残留了部分的水 b.转移时溶液溅到容 量瓶外面
c.定容时俯视容量瓶的刻度线 d.摇匀后见液面下降,再加水至刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于难溶电解质溶解平衡的说法正确的是
A. 可直接根据 Ksp 的数值大小比较难溶电解质在水中的溶解度大小
B. 在 AgCl 的饱和溶液中,加入蒸馏水, Ksp(AgCl)不变
C. 难溶电解质的溶解平衡过程是可逆的,且在平衡状态时 v溶解=v沉淀=0
D. 25℃时, Ksp(AgCl)>Ksp(AgI),向 AgCl 的饱和溶液中加入少量 KI 固体,一定有黄色沉
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.碘是人体不可缺乏的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4
(1)该反应的氧化剂是____;氧化产物与还原产物的物质的量比是___;如果反应生成0.3mol的单质碘,则转移的电子数目是____。
(2)若采用下图实验装置将四氯化碳和I2的混合溶液分离。
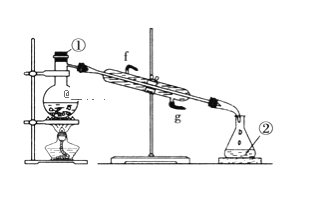
写出图中仪器的名称:①____;该装置还缺少的仪器是__;冷凝管的进水口是:__(填g或f)。
Ⅱ.我校环保兴趣小组在处理污水样品时,需用质量分数为36.5%的浓盐酸密度为1.19 g/cm3配制成250mL 0.1mol·L-1的盐酸溶液。
(1)配制上述溶液除250mL容量瓶、烧杯、胶头滴管、量筒外还需要的玻璃仪器是___。
(2)根据计算,需要36.5%的浓盐酸的体积为______mL。
(3)在量取浓盐酸后,下列操作先后顺序是(用编号表示)_______。
① 待稀释的盐酸温度与室温一致后,沿玻璃棒注入所选定规格的容量瓶中。
② 往容量瓶中小心加蒸馏水至液面接近环形刻度线1~2 cm处,改用胶头滴管加蒸馏水,使凹液面最低处与瓶颈的环形刻度线相切。
③ 在盛盐酸的烧杯中注入适量蒸馏水,并用玻璃棒搅动,使其混合均匀。
④ 用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
(4)假设配制时其他操作均正确,只出现以下哪种情况时,会造成所配制的溶液浓度相比于要求的值偏高? (______)
A.容量瓶中有少量蒸馏水
B.定容时仰视容量瓶读数
C.定容时俯视容量瓶读数
D.配制的溶液装入洁净的但有少量蒸馏水的试剂瓶中
查看答案和解析>>
科目: 来源: 题型:
【题目】人工光合系统装置(如图)可实现以CO2和 H2O 合成CH4。下列有关说法不正确的是()

A. 该装置中铜为正极
B. 电池工作时H+向Cu电极移动
C. GaN 电极表面的电极反应式为: 2H2O-4e-═O2+4H+
D. 反应CO2+2H2O═CH4+2O2中每消耗 1mol CO2转移 4mol e-
查看答案和解析>>
科目: 来源: 题型:
【题目】利用硫酸渣(主要含![]() 、FeO,杂质为
、FeO,杂质为![]() 和
和![]() 等)生产铁基颜料铁黄(FeOOH)的制备流程如下:
等)生产铁基颜料铁黄(FeOOH)的制备流程如下:

(1)FeOOH中Fe元素的化合价为____。
(2)“酸溶”时,所选择的硫酸为溶质质量分数49%,密度![]() ,该硫酸物质的量浓度是___
,该硫酸物质的量浓度是___![]() ,
,![]() 反应的离子方程式为____。
反应的离子方程式为____。
(3)滤渣Ⅰ的主要成分是![]() 和___(填化学式);
和___(填化学式);![]() 被
被![]() 还原的离子方程式为_____。
还原的离子方程式为_____。
(4)“氧化”中,需检验溶液中的离子是否氧化完全,所选用的试剂是____。
(5)滤液Ⅱ中溶质是___(填化学式);洗涤固体的操作是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com