
科目: 来源: 题型:
【题目】“84 消毒液”能有效杀灭甲型 H1N1 病毒,某同学购买了一瓶“威露士”牌“84 消毒液”,该消毒液通常稀释 100 倍(体积比)使用。查阅相关资料和消毒液包装说明得到 如下信息:
① ②NaClO = Na++ClO-
②NaClO = Na++ClO-
(1)该“84 消毒液”的物质的量浓度约为_____(保留 1 位小数)。
(2)某同学取 100mL 该“84 消毒液”,按要求稀释后用于消毒,稀释后的溶液中c(Na+)=_____mol·L1。
(3)该同学参阅该“84 消毒液”的配方,欲用 NaClO 固体配制 480mL 含 NaClO 质量分数为25%的消毒液。下列说法不正确的是____________(填字母)。
A.如下图所示的仪器中,有三种是不需要的,还另需要一种玻璃仪器
B.将称量好的 NaClO 固体在烧杯中溶解后应立即转入容量瓶
C.定容时俯视容量瓶刻度线会导致所配溶液浓度偏高
D.需要称量 NaClO 固体的质量为 149.0g
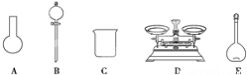
(4)该同学对容量瓶及其使用方法的认识中正确的是_____(填字母)。
A.容量瓶上标有容积、温度和浓度 B.使用前要检查容量瓶是否漏液 C.容量瓶用蒸馏水洗净后,须烘干后再使用 D.配制溶液过程中,容量瓶内液体只需要一次摇匀过程
(5)一瓶上述“威露士”牌“84 消毒液”能吸收空气中_____L 的 CO2(标准状况)而变质。(已 知:CO2+NaClO+H2O=NaHCO3+HClO)
(6)“84 消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用18.4 mol·L-1 的浓 硫酸配制 500 mL2.3 molL﹣1 的稀硫酸用于增强“84 消毒液”的消毒能力,需取用浓硫酸的体 积为______________mL。
(7)在配制过程中,下列操作中能使所配溶液的浓度偏高的有_____(填代号)。
①用量筒量取 98%的硫酸时俯视
②洗涤量取浓硫酸的量筒,并将洗涤液转移到容量瓶中
③未等稀释后的 H2SO4 溶液冷却至室温就转移到容量瓶中
④转移前,容量瓶中含有少量蒸馏水
⑤定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,仰视刻度线
(8)现有密度为 d g/mL 浓度为 18 mol/L 的浓硫酸溶液 100 g ,需要加入一定量的水将其 稀释为浓度是 9 mol/L,则加入水的体积是_____(填字母)
A.大于 100 mL B.小于 l00 mL C.等于 100 mL
查看答案和解析>>
科目: 来源: 题型:
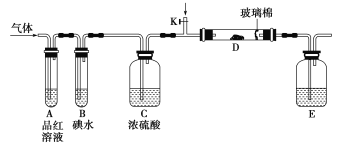
【题目】为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。

(1)气体发生装置B产生的气体是________。
(2)为验证通入装置D中的气体是Cl2过量还是SO2过量,某小组同学准备了以下试剂:
①氯化亚铁溶液 ②硫氰化钾溶液 ③品红溶液 ④酸性高锰酸钾溶液
a.若Cl2过量:取适量D中溶液滴加至盛有__________(选填一个序号)的试管内,再加入________(选填一个序号)试剂,实验现象是_______________________________。
b.若SO2过量:取适量D中溶液滴加至盛有__________(选填一个序号)的试管内,实验现象是________________________________________。
(3)另一小组设计如图所示的装置图(夹持和加热装置略去),分别研究SO2和Cl2的性质。
①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同?_________(填“相同”或“不相同”);
②若装置B中装有5.0 mL 1.0 mol·L-1碘水,当通入足量Cl2完全反应后,共转移了0.05mol电子,该反应的化学方程式为________________________________。
(4)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4∶3;当Cl2与含X的溶液完全反应后,有浅黄色沉淀生成,取上层清液加入氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式:_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】为探究实验室制乙烯及乙烯和溴水的加成反应:甲同学设计了如图所示的实验装置,并进行了实验。当温度升至170℃左右时,有大量气体产生,产生的气体通入溴水中,溴水的颜色迅速褪去。甲同学认为达到了实验目的。乙同学仔细观察了甲同学的整个实验过程,发现当温度升到100℃左右时,无色液体开始变色,到160℃左右时,混合液全呈黑色,在170℃超过后生成气体速度明显加快,生成的气体有刺激性气味。由此他推出,产生的气体中应有杂质,可能影响乙烯的检出,必须除去。据此回答下列问题:

(1)写出甲同学实验中认为达到实验目的的两个反应的化学方程式:__________________。
(2)乙同学观察到的黑色物质是__________,刺激性气体是__________。乙同学认为刺激性气体的存在就不能认为溴水褪色是乙烯的加成反应造成的。原因是(用化学方程表示):________________________________ 。
(3)丙同学根据甲乙同学的分析,认为还可能有CO、CO2两种气体产生。为证明CO存在,他设计了如下过程(该过程可把实验中产生的有机产物除净):发现最后气体经点燃是蓝色火焰,确认有一氧化碳。
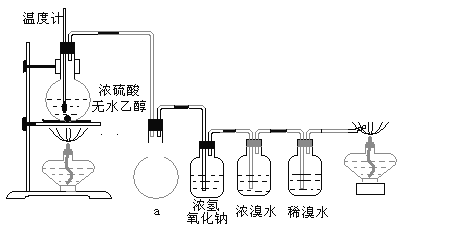
①设计装置a的作用是_____________________________________________
②浓溴水的作用是_________________________________________________,
稀溴水的作用是___________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在如图所示的装置里,若灯泡亮,广口瓶内的物质 A 可以是_____(填序号,下同),其中①~⑧中的电解质有_____。
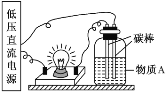
①干燥的氯化钠晶体 ②干燥的氢氧化钠固体 ③蔗糖晶体 ④酒精 ⑤NaHSO4 溶液 ⑥氢氧化钠溶液 ⑦稀盐酸 ⑧Ba(OH)2 溶液
(2)向盛有⑧的溶液中,逐滴加入⑤,当溶液中的Ba2+恰好完全沉淀时,发生反应的离子 方程式为_________。
(3)某无色透明溶液中可能含有下列离子中的一种或几种:Na+、Mg2+、Cu2+、OH-、Cl-、CO32-、NO3-。现进行如下实验:
①用红色石蕊试纸检验,试纸变蓝色。
②另取少量溶液逐滴滴加盐酸至过量,无气体放出,再加入 BaCl2 溶液后,没有沉淀生成。
③另取少量溶液用硝酸酸化后,加入 AgNO3 溶液有白色沉淀生成。 根据上述实验推断:原溶液中肯定有__________离子,肯定没有_____离子。
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应 10NaN3+2KNO3 =K2O+5X+16N2↑,下列说 法不正确的是( )
A.X 的化学式为 Na2O
B.上述反应中 NaN3 被氧化,KNO3 发生还原反应
C.每生成 1.6molN2,则转移的电子为 3 mol
D.若被氧化的 N 原子的物质的量为 3mol,则氧化产物比还原产物多 1.4 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)写出下列基团(或官能团)的名称或结构简式:
﹣CH2CH3_______、﹣Br_______、碳碳三键 _______
(2)乙烯的空间构型 _______
(3)乙炔的电子式_______
(4)苯的同系物的通式_______
(5)![]() 分子式:_______
分子式:_______
(6)![]() 其苯环上的一氯代物有_______ 种
其苯环上的一氯代物有_______ 种
(7)2,5﹣二甲基﹣4﹣乙基庚烷(写出结构简式) _______
(8)4,4,5﹣三甲基﹣2﹣己炔(写出结构简式) _______
(9)![]() 的系统命名是_______
的系统命名是_______
(10)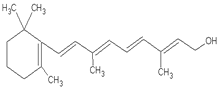 1mol该物质消耗_______molH2,_______molBr2 _______molNa
1mol该物质消耗_______molH2,_______molBr2 _______molNa
(11)鉴别苯,碘化钾溶液,硝酸银溶液,己烯,四氯化碳时,只能用一种试剂,该试剂是_____;
(12)写出C5H8属于炔烃的所有同分异构体__________.
查看答案和解析>>
科目: 来源: 题型:
【题目】某结晶水合物的化学式为 RnH2O,其相对分子质量为 M。25 ℃时,a g 该晶体能够溶 于 b g 水中形成 V mL 饱和溶液。下列关系中不正确的是( )
A.该溶液中溶质的质量分数为 w=![]()
B.该溶液的物质的量浓度为 c=![]()
C.25 ℃时 R 的溶解度为 S= ![]() g
g
D.该溶液的密度为 ρ=![]() g/mL
g/mL
查看答案和解析>>
科目: 来源: 题型:
【题目】某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1 mol/L。
阳离子 | K+、Mg2+、Fe3+、Al3+、Fe2+ |
阴离子 | Cl-、 |
某同学欲探究废水的组成,进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
②取少量溶液,加入KSCN溶液无明显变化。
③另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
④向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由①、②、③判断,溶液中一定不含有的阴离子是______________,一定不含有的阳离子是_____________(写离子符号)。
(2)③中加入少量盐酸生成无色气体的离子方程式是___________________________,④中生成白色沉淀的离子方程式是___________________________。
(3)将③中所得红棕色气体通入水中,气体变无色,所发生反应的化学方程式为__________________________。
(4)该同学最终确定原溶液中所含阴离子是___________,阳离子是________________写离子符号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】关于乙醇 在化学反应中断键位置说法错误的是 ( )
在化学反应中断键位置说法错误的是 ( )
A. 乙醇与浓硫酸在170℃时,在②③位置断裂,以水分子的形式消去,属于消去反应。
B. 乙醇与钠反应,在④位置断裂,对比钠与水反应,乙醇比水更难失去氢离子。
C. 乙醇与浓硫酸在140℃时,在③或④位置断裂,该反应属于取代反应。
D. 乙醇在铜催化下与氧气反应,在②④位置断裂,所以只有与羟基直接相连的碳原子上有氢原子才能发生催化氧化。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L硫酸溶液450mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是_________(填序号),本实验所用玻璃仪器E的规格和名称为_____________。

(2)下列操作中,容量瓶所不具备的功能有__________(填序号)
a.配制一定体积准确浓度的标准溶液 b.长期贮存溶液
c.用来加热溶解固体溶质 d.量取220毫升体积的液
(3)如果实验室有l0mL、25mL、50mL量筒,根据计算得知:量取质量分数为98%、密度为1.84g.cm-3的浓硫酸应选用__________mL规格的量筒最好。
(4)在配制NaOH溶液实验中,其他操作均正确,若定容时仰视刻度线,则所配制溶液浓度_______0.1mol/L(填“大于”“等于”或“小于”,下同)。若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度__________0.1mol/L。
(5)如果定容时不小心超过刻度线,应如何操作__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com