
科目: 来源: 题型:
【题目】某学生为确定某烃的分子式及其可能的结构简式,做了如下实验:标准状况下,取0.1 mol该烃,在氧气中完全燃烧,生成的二氧化碳体积为22.4 L,同时得到16.2 g水。
(1)该烃的摩尔质量为________。
(2)该烃的分子式为________。
(3)该烃有一种可能的结构为  ,属于________(选填序号)。
,属于________(选填序号)。
A.环烃 B.烷烃 C.芳香烃 D.不饱和烃
查看答案和解析>>
科目: 来源: 题型:
【题目】若以NA代表阿伏加德罗常数的值,下列说法中正确的是
A.20g NaOH溶于1L水,可配得0.5mol/LNaOH溶液
B.100mL 0.1mol/L硫酸溶液中含有的氧原子数约为0.04NA
C.5 mL 0.3 mol/L Na2SO4溶液和5 mL 0.3 mol/L NaNO3溶液Na+ 物质的量浓度相等
D.a g C2H4和C3H6的混合物所含碳原子数为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】一种新型的合成氨的方法如图所示,下列说法正确的是
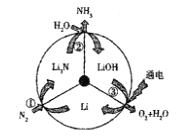
A. 反应①属于“氮的固定”B. 反应②属于氧化还原反应
C. 反应③可通过电解![]() 水溶液实现D. 上述三步循环的总结果为:
水溶液实现D. 上述三步循环的总结果为:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)质量为 3.9 g 的 Na2X 中含有 Na+的物质的量为 0.1mol,则 Na2X 的摩尔质 量为_____。
(2)在标准状况下,1.6 g 某气态氧化物 RO2 体积为 0.56L,R 的相对原子质量为________。
(3)3.01×1022 个 S2- 含有电子的物质的量为_____________。
(4)0.3NA 个硫酸分子与____________ g 磷酸(H3PO4)含有相同的氧原子数。
查看答案和解析>>
科目: 来源: 题型:
【题目】CuBr是一种白色晶体,见光或潮湿时受热易分解,在空气中逐渐变为浅绿色。实验室制备CuBr的反应原理为:SO2+2CuSO4+2NaBr+ 2H2O=2CuBr↓+2H2SO4+Na2SO4,用下列装置进行实验,不能达到实验目的的是
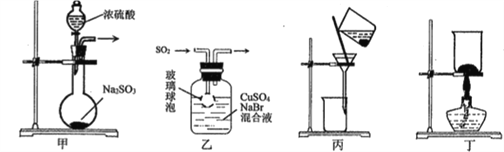
A. 用装置甲制取SO2 B. 用装置乙制取CuBr
C. 用装置丙避光将CuBr与母液分离 D. 用装置丁干燥CuBr
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋是巨大的资源宝库,除了可以得到氯化钠还可以从海带中提取碘。碘是人 体不可缺乏的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定 量的 KIO3 进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其 检测原理是:KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4
(1)氧化产物与还原产物的物质的量比是_____;如果反应生成 0.3mol 的单质碘,则转 移的电子数目是_____。
(2)先取少量的加碘盐加蒸馏水溶解,然后加入稀硫酸和 KI 溶液,最后加入一定量的 CCl4, 振荡,这时候,观察到的现象是_____。
(3)若采用下图实验装置将四氯化碳和 I2 的混合溶液分离。
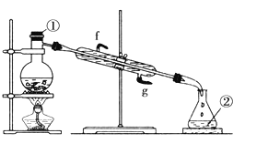
该装置还缺少的仪器是_______;冷凝管的进水口是:_______ (填 g 或 f)。
查看答案和解析>>
科目: 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列有关叙述错误的是
A. 1mol月球表面的氦-3(![]() )含有质子为2NA
)含有质子为2NA
B. 1L![]() 的
的![]() 溶液中,含有0.1NA个
溶液中,含有0.1NA个![]()
C. 标准状况下,22.4L![]() 中所含分子数为NA
中所含分子数为NA
D. 标准状况下,1mol金刚石中含有的C-C键数目为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】1684 年,波义耳出版了一部名为《人血的自然史略》的医学著作,在这本书里, 他总结了自己在血液分析方面的实验成果。这是有史以来,人类第一次将化学分析方法用于 临床医学。通过实验,波义耳证明了血液中含有氯化钠,并将之称为固定盐。科研人员从海水得到的粗盐中含有泥沙等不溶性杂质,以及可溶性杂质:Ca2+,Mg2+,SO42-等,提纯的流程如下图:
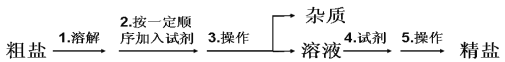
(1)整个流程中首先将粗盐溶解,再通过以下实验步骤进行提纯:①过滤②加过量 NaOH 溶 液③加适量盐酸④加过量 Na2CO3 溶液⑤加过量 BaCl2 溶液。
以下操作顺序不合理的是_____(填字母)
A.②⑤④③① B.④⑤②①③ C.⑤②④①③ D.⑤④②①③
除去 Mg2+的离子方程式_________。
(2)实验室将上述得到的精制食盐水制成精盐的过程中,还需要进行某一操作,该操作中 需要加热的仪器为:_____。
(3)下列实验仪器,可用酒精灯直接加热的是_______(填字母)
①试管 ②量筒 ③圆底烧瓶 ④烧杯 ⑤容量瓶 ⑥锥形瓶 ⑦燃烧匙
A. ①③④⑥⑦ B. ①⑦ C. ①③④⑤⑥ D. ①②③④⑤⑥⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用乙醇制取乙烯的装置如下图,回答下列问题。

(1)仪器A的名称是__________ ;A中加入沸石的目的是 __________;在烧杯中配制A中溶液的方法是__________ ;在反应中浓硫酸的作用是__________;A中发生反应的化学方程式是 __________ 。
(2)A中产生的气体除乙烯外,还可能混有少量 __________(填化学式)
(3)用乙烯制聚乙烯的化学方程式为 __________
查看答案和解析>>
科目: 来源: 题型:
【题目】铜、铁、铝是重要的金属材料,铜、铁、铝及其化合物有非常重要的用途。
(1)高铁酸钾(K2FeO4)是一种高效多功能水处理剂。湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO 、OH 、FeO42、Cl 、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:________________________________。
②若反应过程中转移了 0.3mol 电子,则还原产物的物质的量为_______mol。
(2)以铝土矿(主要成分为Al2O3和Fe2O3、SiO2)为原料制备铝的一种工艺流程如下:
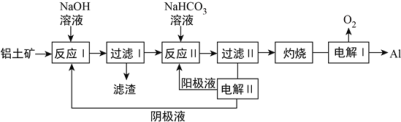
①滤渣主要成分为________。
②在实验室灼烧操作应选择的实验仪器为_________。
③反应II中,加入NaHCO3一段时间才有沉淀生成,写出加入少量NaHCO3时发生反应的离子方程式____________________________________。
(3)已知25 ℃时Ksp[Cu(OH)2]=2.2×1020,Ksp[Al(OH)3]=1.1×1033。在25 ℃下,向浓度均为0.1 mol·L1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成_________沉淀(填化学式)。
(4)以含有少量硫酸的硫酸铜溶液为原料制备铜:a g铁粉与上述溶液完全反应后,得到a g铜,则参与反应的CuSO4与H2SO4的物质的量之比为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com