
科目: 来源: 题型:
【题目】建筑工地常用的NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。己知NaNO2和HI能发生如下反应:______NaNO2 +_______HI →_________NO↑+_____ I2 + _________NaI +_____
(1)请将生成物补充完整并配平,并用单线桥法标出电子转移的方向和数目。___________
(2)上述反应中氧化剂与还原剂的物质的量之比为_________,若标准状况下生成3.36L NO,则反应中转移电子的数目是______________。
(3)根据上述反应,可用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:①水 ②淀粉碘化钾试纸 ③淀粉 ④白酒⑤食醋,进行实验选用物质合适的是______(填字母编号)。
A.①③ ⑤ B.①② ④ C.①②⑤ D.②④⑤
(4)某工厂废液中,含有2%—5%的NaNO2,直接排放会造成污染,采用NH4Cl能使NaNO2转化为不引起二次污染的N2,反应的化学方程式为_______________。
(5)把氯气通到NaNO2溶液中,生成NaNO3和HCl,写出反应的离子方程式:______。
(6)亚硝酸盐可将正常的携氧亚铁血红蛋白转化成三价铁血红蛋白,失去携氧能力,引起组织缺氧导致中毒。美蓝是亚硝酸盐中毒的有效解毒剂。下列说法中不正确的是_______。
A.在中毒过程中携氧亚铁血红蛋白被氧化 B.中毒时亚硝酸盐发生氧化反应
C.药品美蓝应具有还原性 D.解毒时三价铁血红蛋白被还原
查看答案和解析>>
科目: 来源: 题型:
【题目】有关物质结构、性质的说法中正确的是 ( )
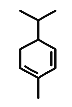
①烃的密度比水的密度小
②C2H6、C4H10、C6H14在常温下均为气体
③1 mol苯最多与3 mol H2发生加成反应,是因为苯分子含有3个碳碳双键
④水芹烯(桂皮中的一种成分)键线式如图,其分子式为C10H16
⑤CH2=CH2与CH2=CH-CH=CH2互为同系物
⑥甲烷与氯气在光照的条件下可以制取纯净的一氯甲烷
⑦C5H12有三种同分异构体
A. ①②⑤B. ③④⑦C. ③⑤⑥D. ①④⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A 元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2。
(1)六种元素中第一电离能最小的是 (填元素符号,下同),电负性最大的是 。
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂)。请写出黄血盐的化学式 ,1 mol AB-中含有π键的数目为 ,黄血盐晶体中各种微粒间的作用力不涉及 (填选项字母)。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.分子间的作用力
(3)E2+的价层电子排布图为 ,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③![]() 、④HCHO。其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质) 。
、④HCHO。其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质) 。
(4)金属C、F晶体的晶胞结构如图(请先判断对应的图),C、F两种晶体晶胞中金属原子的配位数之比为 。金属C的晶胞中,若设该晶胞的密度为a g/cm3,阿伏加德罗常数的值为NA,C原子的摩尔质量为M,则表示C原子半径的计算式为 cm。

查看答案和解析>>
科目: 来源: 题型:
【题目】1,3﹣丁二烯和2﹣丁炔分别与氢气反应的热化学方程式如下:CH2=CH﹣CH=CH2 (g)+2H2 (g)→ CH3CH2CH2CH3 (g) H=-236.6kJ/mol CH3﹣C≡C﹣CH3 (g)+2H2 (g)→ CH3CH2CH2CH3 (g) H=-272.7kJ/mol。由此不能判断 ( )
A. 1,3﹣丁二烯和2﹣丁炔稳定性的相对大小
B. 1,3﹣丁二烯和2﹣丁炔分子储存能量的相对高低
C. 1,3﹣丁二烯和2﹣丁炔相互转化的热效应
D. 一个碳碳叁键的键能与两个碳碳双键的键能之和的大小
查看答案和解析>>
科目: 来源: 题型:
【题目】如图a酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是由碳粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电过程产生MnOOH,下列说法不正确的是
有关数据如下表所示:
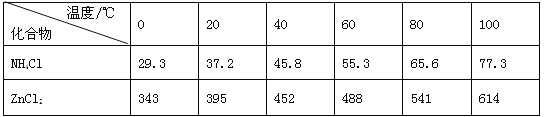
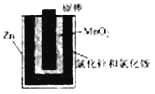
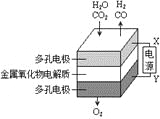
图a 图b
A. 该电池的正极反应式为MnO2+eˉ+H+==MnOOH
B. 利用干电池,高温电解H2O—CO2混合气体制备H2和CO,如图b,则阴、阳两极生成的气体的物质的量之比是1:1
C. 废电池糊状填充物加水处理后,过滤,滤液中主要有氯化锌和氯化铵,两者可以通过重结晶方法分离
D. 废电池糊状填充物加水处理后所得滤渣的主要成分是二氧化锰、碳粉和MnOOH,欲从中得到较纯的二氧化锰,可以采用加热的方法
查看答案和解析>>
科目: 来源: 题型:
【题目】已知断裂1mol化学键吸收的能量或形成1mol化学键释放的能量称为键能,部分物质的键能如下表所示:
化学键 | C-H | C=O | N-H | C-N | H-O |
键能(kJ/mol) | a | b | c | d | e |
甲醛制备乌洛托品的反应如下,6![]() (g) + 4NH3(g) →
(g) + 4NH3(g) →  + 6H2O(l)
+ 6H2O(l)
该反应的⊿H为 ( )
A. 6(a+b+c-d-e)kJ/molB. 6(d+e-a-b-c)kJ/mol
C. 6(b+2c-2d-2e)kJ/molD. 6(2d+2a+2e-b-3c)kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物TPE具有聚集诱导发光特性,在光电材料领域应用前景广阔,其结构简式如下图所示。下列有关该有机物说法正确的是
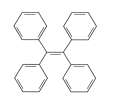
A. 分子式为C26H22 B. 属于苯的同系物
C. 一氯代物有3种 D. 能溶于水和酒精
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作与预期实验目的或所得实验结论不一致的是( )
选项 | 实验操作 | 实验目的或结论 |
A、 |
| 通过观察液面差判断该装置的气密性 |
B、 | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤 | 除去MgCl2溶液中少量FeCl3 |
C、 | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗涤的沉淀中加稀盐酸,有气泡产生 | 说明常温下Ksp(BaCO3)<Ksp(BaSO4) |
D、 | C2H5OH与浓硫酸170℃共热,制得的气体通入酸性KMnO4溶液 | 不能检验制得气体是否为乙烯 |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下列物质中:①SO2 ②液态氯化氢 ③CH4 ④熔融NaOH ⑤NH4Cl固体 ⑥氨水。能导电的是__________(填序号,下同)。属于电解质的是__________。属于非电解质的是__________。
(2)1.204×1024个H2SO4分子的物质的量为__________mol,共含__________个氢原子。将上述H2SO4溶于水配成600 mL溶液,再加水稀释到1000 mL,稀释后溶液的物质的量浓度为__________mol/L。
(3)K2SO4和Fe2(SO4)3的混合溶液,已知其中Fe3+的浓度为0.5mol/L,SO42-浓度为0.9mol/L,则K+的物质的量浓度为__________mol/L。
(4)有以下四种物质:① 标准状况下11.2 L CO2 ② 5 g H2 ③ 1.204×1024个N2分子 ④ 18 g H2O,其中质量最大的是____(填序号),在常温常压下体积最大的是___(填序号)。
(5)标准状况下11.2 L由CH4、N2组成的混和气体的质量为10 g,该混合气体中CH4与N2的分子数之比为_________。
(6)将标准状况下336 L HCl气体完全溶于1 L水中,所得溶液的密度为 ρ g/cm3,则该溶液的物质的量浓度为_____ mol/L(计算结果中的数字保留整数)
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA
B. 标准状况下,2.24L NO和2.24L O2混合后气体分子数为0.15 NA
C. 加热条件下,1mol Fe投入足量的浓硫酸中,生成NA个SO2分子
D. 0.1mol Na2O2与足量的潮湿的二氧化碳反应转移的电子数为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com