
科目: 来源: 题型:
【题目】(1)将Mg条放入浓NH4Cl溶液中产生无色气体,该气体是________(填化学式),请用离子方程式解释该现象产生的原因________________。
(2)Mg(OH)2浊液中存在Mg(OH)2的沉淀溶解平衡,可表示为(用离子方程式表示)____________,若向此浊液中加入浓的NH4Cl溶液,观察到的现象是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯碱工业中电解饱和食盐水的原理示意图如下图所示。
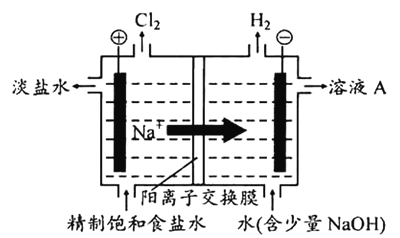
(1)溶液A的溶质是_______。
(2)电解饱和食盐水的离子方程式是_______。
(3)电解时用盐酸控制阳极区溶液的pH在2~3。用化学平衡移动原理解释盐酸的作用:_______。
(4)电解所用的盐水需精制,去除有影响的Ca2+、Mg2+、NH4+、SO42-[c(SO42-)>c(Ca2+)]。精制流程如下(淡盐水和溶液A来自电解池):
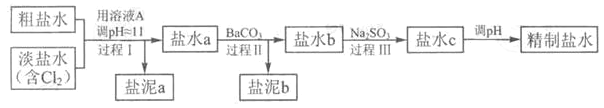
①盐泥a除泥沙外,还含有的物质是________。
②过程I中将NH4+转化为N2的离子方程式是________。
③BaSO4的溶解度比BaCO3的小。过程II中除去的离子有________。
④过程III中Na2SO3的作用是除去盐水b中的NaClO,参加反应的Na2SO3与NaClO的物质的量之比为________。
查看答案和解析>>
科目: 来源: 题型:
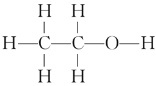
【题目】乙醇(C2H5OH)是生活中常见的物质,下图给出了乙醇的结构式和球棍模型。

I.乙醇燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。
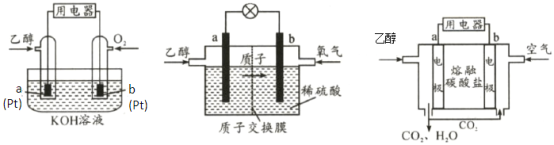
碱性乙醇燃料电池 酸性乙醇燃料电池 熔融盐乙醇燃料电池
(1)三种乙醇燃料电池中正极反应物均为_______。(填化学式)
(2)碱性乙醇燃料电池中,电极a上发生的电极反应式为_______,使用空气代替氧气,电池工作过程中碱性会不断下降,其原因是_______。
(3)酸性乙醇燃料电池中,电极b上发生的电极反应式为_______。
(4)熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,CO32-向电极_______(填“a”或“b”)移动。
II. 已知气相直接水合法可以制取乙醇:H2O(g)+C2H4(g)![]() CH3CH2OH(g)。当n(H2O):n(C2H4)=1:1时,乙烯的平衡转化率与温度、压强的关系如下图:
CH3CH2OH(g)。当n(H2O):n(C2H4)=1:1时,乙烯的平衡转化率与温度、压强的关系如下图:
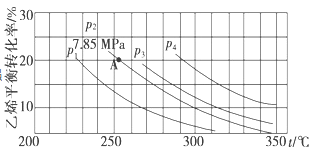
(1)图中压强p1、p2、p3、p4的大小顺序为:_______,理由是:_______。
(2)气相直接水合法采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290℃,压强6.9 MPa,n(H2O):n(C2H4)=0.6:1。该条件下乙烯的转化率为5%。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有_______、_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应:①2Mg+O2![]() 2MgO;②3Mg+N2
2MgO;②3Mg+N2![]() Mg3N2;③2Mg+CO2
Mg3N2;③2Mg+CO2![]() 2MgO+C;④Mg+H2O
2MgO+C;④Mg+H2O![]() MgO+H2↑;⑤Mg3N2+6H2O
MgO+H2↑;⑤Mg3N2+6H2O![]() 3Mg(OH)2+2NH3↑
3Mg(OH)2+2NH3↑
可供选择的装置和药品如图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。


回答下列问题:
(1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别是_____;
(2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)___;
(3)通气后,如果同时点燃A、F装置的酒精灯,对实验结果有何影响?____,原因是____;
(4)请设计一个实验,验证产物是氮化镁:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化硫的催化氧化反应:2SO2(g)+O2(g)![]() 2SO3(g)是工业制硫酸的重要反应之一。下列说法错误的是
2SO3(g)是工业制硫酸的重要反应之一。下列说法错误的是
A. 煅烧硫铁矿(主要成分FeS2)可获得SO2,将矿石粉碎成细小颗粒可以提高反应的转化率
B. 已知该催化氧化反应K(300℃)>K(350℃),则该反应正向是放热反应
C. 该反应加入催化剂是为了加快反应速率
D. 保持温度不变,平衡后增大O2的浓度,该反应的平衡常数K不变
查看答案和解析>>
科目: 来源: 题型:
【题目】一定体积的酸性KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.2000 mol·L-1的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·L-1)为( )
A.0.0176B.0.1600C.0.1200D.0.2400
查看答案和解析>>
科目: 来源: 题型:
【题目】表示下列变化的化学用语正确的是
A. 氨水显碱性:NH3·H2O![]() NH4++OH-
NH4++OH-
B. 醋酸溶液显酸性:CH3COOH=CH3COO-+H+
C. NaHCO3溶液显碱性:HCO3-+H2O![]() CO32-+OH-
CO32-+OH-
D. 铁在潮湿空气中被腐蚀的负极反应:Fe-3e-=Fe3+
查看答案和解析>>
科目: 来源: 题型:
【题目】研究含氮污染物的治理是环保的一项重要工作。合理应用和处理氮的化合物,在生产生活中有重要意义。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJmol﹣1
2C(s)+O2(g)=2CO(g) △H=﹣221.0kJmol﹣1
C(s)+O2(g)=CO2(g) △H=﹣393. 5kJmol﹣1
则汽车尾气处理的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=_____ kJmol﹣1,利于
该反应自发进行的条件是_______(选填“高温”或“低温”)。

(2)将0.20mol NO和0.10molCO充入一个容积恒定为1L的密闭容器中发生反应:
2NO(g)+2CO(g)N2(g)+2CO2(g),反应过程中 部分物质的浓度变化如图所示:
反应从开始到9min时,用CO2表示该反应的速率是____________________(保留2位有效数字)
②第12min时改变的条件是______________(填“升温或降温”).
③第18min时建立新的平衡,此温度下的平衡常数为______________(列计算式),第24min时,若保持温度不变,再向容器中充入CO和N2各0.060mol,平衡将_____移动(填“正向”、“逆向”或“不”)。
(3)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在t1时刻达到平衡状态的是________________(填序号)。
(如图中v正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)
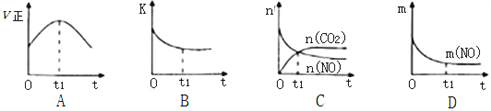
(4)以氨为燃料可以设计制造氨燃料电池,产物无污染。若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为______________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】2016年我国科研人员研制出一种室温“可呼吸”NaCO2电池。放电时该电池“吸入”CO2,充电时“呼出”CO2。吸入CO2时,其工作原理如右图所示。吸收的全部CO2中,有2/3转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。下列说法正确的是:

A.“吸入”CO2时,钠箔为正极
B.“呼出”CO2时,Na+向多壁碳纳米管电极移动
C.“吸入”CO2时的正极反应:4Na+ + 3CO2 + 4e—= 2Na2CO3 + C
D.标准状况下,每“呼出”22.4LCO2,转移电子数为0.75mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是
A.在一定温度和压强下,各种气态物质体积大小由分子间距离决定
B.相同温度时,CO2和N2O若体积相同,则它们的质量一定相同
C.100g浓度为18mol/L的浓硫酸中加入等质量的水稀释浓度大于9mol/L
D.14 mol/L的H2SO4溶液的溶质质量分数为80%,那么7 mol/L的H2SO4溶液的溶质质量分数将大于40%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com