
科目: 来源: 题型:
【题目】A~G各物质间的关系如下图所示,其中B、D为气体单质。则下列说法错误的是

A.已知C的浓溶液在催化剂存在的条件下加热,能与B反应生成D,由此可以推断B的氧化性比MnO2强
B.反应②的离子方程式为![]()
C.新配制的F溶液一般需要加入铁屑和稀盐酸,前者用于防止Fe2+被空气氧化成Fe3+,后者可抑制Fe2+的水解
D.若反应①在常温下进行,则1molA在反应中能转移1mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知 Fe3+在 pH=5时沉淀完全).其中分析错误的是

A. 步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O
B. 步骤②不能用氯水、硝酸等强氧化剂代替H2O2
C. 步骤④为过滤,步骤⑤蒸发结晶
D. 步骤③用 CuCO3代替CuO也可调节溶液的pH
查看答案和解析>>
科目: 来源: 题型:
【题目】利用SCR技术可有效降低柴油发动机NOx排放。SCR工作原理为尿素[CO(NH2)2]水溶液热分解为NH3和CO2,再利用NH3转化NOx,装置如图所示,下列说法不正确的是( )

A.转化NO2过程的化学方程式为:8NH3+6NO2![]() 7N2+12H2O
7N2+12H2O
B.转化器工作过程中,当转移0.6mol电子时,会消耗4.48LNH3
C.尿素水溶液热分解反应不属于氧化还原反应
D.该装置转化NO时,还原剂与氧化剂物质的量之比为2:3
查看答案和解析>>
科目: 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 在标准状况下,11.2L HF含有的分子数目为0.5NA
B. 高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子
C. 常温下,0.2 L 0.5 mol·L-1 NH4NO3溶液中含有的氮原子数小于0.2NA
D. 18g葡萄糖(C6H12O6)分子含有的羟基数目为0.6NA
查看答案和解析>>
科目: 来源: 题型:
【题目】已知草酸H2C2O4(一种二元弱酸)能使酸性高锰酸钾溶液褪色,其反应可以表示如下:2KMnO4+3H2SO4+5H2C2O4=K2SO4+2MnSO4+10X↑+8H2O
(1)已知相同条件下X气体对H2的相对密度为22,则X的化学式为__;
(2)该反应中的氧化剂是__,还原剂是__(填化学式)。
(3)若该反应中生成的还原产物的物质的量为0.2mol,则生成的X气体在标况下的体积为__。
(4)写出该反应的离子方程式:__。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有Al、Cl2、Al2O3、HCl(aq)、A1(OH)3、NaOH(aq)六种物质,它们之间有如图所示转化关系,图中每条线两端的物质之间都可以发生反应,下列推断中不合理的是( )
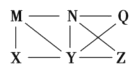
A. N一定是HCl(aq)B. X可能是Al或Cl2
C. Q、Z中的一种必定为A12O3D. Y一定为NaOH(aq)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)写出制备氢氧化铁胶体的化学方程式:___;
(2)写出盐酸除铁锈(主要成分Fe2O3)的离子方程式:___;
(3)写出NaHSO4溶液与Ba(OH)2溶液混合呈中性的离子方程式:___;
(4)写出NaHCO3溶液与少量澄清石灰水反应的离子方程式:___;
(5)写出硫酸铜溶液与氢氧化钡溶液反应的离子方程式:__。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室里需240mL0.1mol/L的CuSO4溶液。
(1)配制该溶液因选__mL容量瓶,以下配制方法正确的是__(填字母)。
A.称取3.84gCuSO4溶于盛有250mL水的烧杯中
B.称取6.0g胆矾溶于盛有250mL水的烧杯中
C.称取4.0gCuSO4溶于盛有250mL水的烧杯中
D.称取6.25g胆矾配成250mL溶液
(2)假如其它操作均正确无误,分析下列情况对配制溶液浓度的影响(填“偏高”“偏低”“不变”)
A.定容时俯视观察刻度线:___;
B.移液时,对于溶解CuSO4(或胆矾)的烧杯没有洗涤:___;
C.定容后,将容量瓶振荡摇匀,静置时发现液面低于刻度线,又补加水至刻度线:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】沉淀的生成、溶解和转化在无机物制备和提纯以及科研等领域有广泛应用。已知25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=1×10-9。
(1)将浓度均为0.1 mol·L-1的BaCl2溶液与Na2SO4溶液等体积混合,充分搅拌后过滤,滤液中c(Ba2+)=_____mol·L-1。
(2)医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂。胃酸酸性很强( pH约为1), 但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是_______________________。(用沉淀溶解平衡原理解释)。万一误服了少量BaCO3,应尽快用大量0.5mol·L-1Na2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为________mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,某反应体系中存在六种粒子:ClO4-、SO42-、ClO3-、S2O82-、H+、H2O。在反应过程中,溶液的 pH 与反应进程的关系如图所示。下列说法正确的是

A. ClO4-是氧化剂
B. SO42-是氧化产物
C. 氧化性:S2O82->ClO3-
D. 生成 1 mol 还原产物时转移 2 mol 电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com