
科目: 来源: 题型:
【题目】氮化铝广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过反应:Al2O3+N2+3C![]() 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
A. AlN中氮的化合价为+3B. 上述反应中,每生成1 mol AlN需转移3 mol电子
C. AlN的摩尔质量为41 gD. 上述反应中,N2是还原剂,Al2O3是氧化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度压强下,用相同质量的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是

A. 气球B中装的是O2B. 气球A和气球D中气体物质的量之比为4:1
C. 气球A和气球C中气体分子数相等D. 气球C和气球D中气体密度之比为2:1
查看答案和解析>>
科目: 来源: 题型:
【题目】拆开1 mol 共价键所吸收的能量或形成1 mol 共价键所释放的能量称为键能。已知:H-H键能为436 kJ /mol,H-N键能为391 kJ /mol, N2 (g)+ 3H2(g) ![]() 2NH3(g) △H=-92.4 kJ /mol,下列说法中正确的是( )
2NH3(g) △H=-92.4 kJ /mol,下列说法中正确的是( )
A. H-H比N≡N更牢固
B. N≡N键能约为946 kJ/mol
C. 合成氨反应选择适当的催化剂是为了提高H2的转化率
D. 0.5 mol N2和1.5 mol H2在题给条件下充分反应,放出热量为46.2 kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃、101 kPa时,强酸与强碱的稀溶液中发生中和反应的中和热为57.3 kJ·mol-1,则下列描述正确的是
A. KOH(aq)+![]() H2SO4(aq)===
H2SO4(aq)===![]() K2SO4(aq)+H2O(1) ΔH=-57.3 kJ·mol-1
K2SO4(aq)+H2O(1) ΔH=-57.3 kJ·mol-1
B. NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(1) ΔH=+57.3 kJ·mol-1
C. H2SO4和Ca(OH)2反应的中和热为ΔH=2×(-57.3) kJ·mol-1
D. 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
查看答案和解析>>
科目: 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:
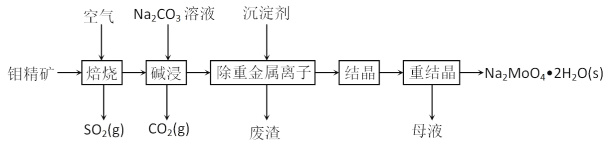
回答下列问题:
(1)提高焙烧效率的方法有_______________________。(写一种)
(2)“焙烧”时MoS2转化为MoO3,该反应过程的化学方程式为____________________,氧化产物是__________________
(3)“碱浸”时生成CO2的电子式为______________,碱浸”时含钼化合物发生的主要反应的离子方程式为____________________________。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为____________________。
(5)钼精矿在酸性条件下,加入NaNO3溶液,也可以制备钼酸钠,同时有SO42-生成,该反应的离子方程式为____________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O是一种氧气吸收剂,为红棕色晶体,易被氧化,难溶于冷水,易溶于酸。其制备装置及步骤如下:
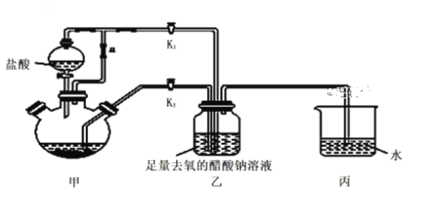
①检查装置气密性后,往三颈烧瓶中依次加入过量锌粒、适量CrCl3溶液。
②关闭K2,打开K1,旋开分液漏斗的旋塞并控制好滴速。
③待三颈烧瓶内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,将溶液转移至装置乙中,当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥,称量得到3.76 g [Cr(CH3COO)2]2·2H2O
(1)三颈烧瓶中的Zn与盐酸生成H2的作用____________,还发生的另一个反应的离子方程式为______________。
(2)实现步骤③中溶液自动转移至装置乙中的实验操作为______________,当乙中析出红棕色沉淀,为使沉淀充分析出并分离,需采用的操作是___________ 、_________、洗涤、干燥。
(3)装置丙中导管口水封的目的是______________。
(4)若实验所取用的CrCl3溶液中含溶质6.34 g,则[Cr(CH3COO)2]2·2H2O (相对分子质量为376)的产率是_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组为证实Ba(OH)2溶液和H2SO4溶液的反应是离子反应,设计了如下实验。请补充完成该实验报告。
(1)(实验原理)
溶液的导电性由溶液中离子的浓度及离子电荷数决定。观察_____,据此判断溶液中自由移动的离子浓度的变化,从而证明反应是离子反应。
(2)(实验装置)如图1所示。

(实验过程与记录)
实验步骤 | 实验现象 | 实验结论 |
连接好装置,向烧杯中加入25mL1molL﹣1的Ba(OH)2溶液和2滴酚酞溶液,逐滴滴加1molL﹣1的H2SO4溶液直至过量,边滴边振荡。 | (2)_____(填写支持实验结论的证据) | Ba(OH)2溶液和H2SO4溶液的反应是离子反应 |
(3)整个过程中混合溶液的导电能力(用电流强度Ⅰ表示)可近似地用图2中的_____(填序号)曲线表示。
(4)下列三种情况下,与上述实验中离子方程式相同的是_____。
A 向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42﹣恰好完全沉淀
B 向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至至溶液显中性
C 向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(5)已知:PbSO4难溶于水,但可溶于醋酸氨溶液中形成无色溶液,其化学方程式为:PbSO4+2CH3COONH4=(CH3COO)2Pb+(NH4)2SO4.写出该反应的离子方程式为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】键线式是表达有机化合物结构的一种方式,如H2N-CH2-CH2-OH用键线式可以表达为![]()
吡喹酮(H)是一种治疗血吸虫病的药物,合成路线如下图所示:
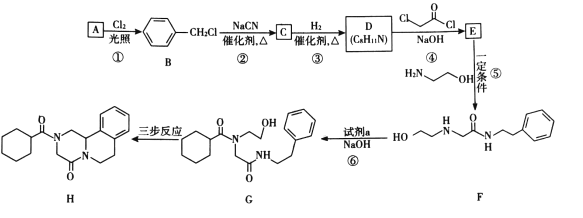
已知i.R-Cl+NaCN![]() R-CN+NaCl
R-CN+NaCl
ii.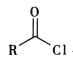 +R′-NH-R″+NaOH
+R′-NH-R″+NaOH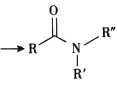 +NaCl+H2O
+NaCl+H2O
(1)A属于芳香烃,其名称是____。
(2)②的反应类型是____。
(3)B的一种同分异构体,含苯环且核磁共振氢谱中出现三组峰,其结构简式为____。
(4)③中1 mol C理论上需要消耗____mol H2生成D。
(5)④的化学方程式是____。
(6)F中含氧官能团是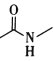 和____。
和____。
(7)试剂a的结构简式是____。
(8)G→H分为三步反应,J中含有3个六元环,写出I、J的结构简式______、______。

查看答案和解析>>
科目: 来源: 题型:
【题目】摩尔盐[(NH4)2Fe(SO4)2·6H2O]是一种重要的化工原料,用途广泛。几位同学进行了如下实验以检验摩尔盐溶液中的NH4+、Fe2+、SO42-。
完成下列填空:
(1)甲同学向试样溶液中加入足量的Ba(OH)2溶液,微热,逸出可使_______试纸变蓝的气体以检验NH4+离子,同时生成白色沉淀,随即沉淀变为灰绿色,最后带有_________色,用足量_______溶液处理沉淀物,沉淀部分溶解以检验Fe2+、SO42-;
(2)乙同学提出检验Fe2+的方法:先向试样溶液中滴加KSCN,溶液呈无色,再加___________试剂,溶液呈血红色则有Fe2+。但实际操作中,乙同学向试样溶液中加入KSCN后,发现溶液变成浅红色,原因是________________;
丙同学欲测定某摩尔盐样品中Fe2+的含量。他称取0.400g该样品,溶于水,加入适量稀硫酸后,用0.0200mol/L的KMnO4溶液滴定,消耗KMnO4溶液10.00mL。
反应的离子方程式为:5Fe2++MnO4-+8H+→Mn2++5Fe3++4H2O。
(3)滴定终点的现象是_______________________,样品中Fe2+的百分含量是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊.A受热分解的化学方程式为_____.
(2)称取两种固体各2g,分别加入两个小烧杯中,再各加10mL 蒸馏水,振荡,恢复至室温,发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论_____.
(3)如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中.
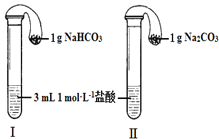
①两试管中均产生气体,_____(填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈.
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是_____.
a 装置 I的气球体积较大 b 装置Ⅱ的气球体积较大
c 装置 I的气球体积等于装置Ⅱ的气球体积 d 无法判断
(4)同学们将两种固体分别配制成0.5molL﹣1的溶液,设计如下方案并对反应现象做出预测:
实验方案 | 预测现象 | 预测依据 |
操作1:向2mL Na2CO3溶液中滴加1mL 0.5molL﹣1CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32﹣浓度较大,能与CaCl2发生反应__________(写离子方程式). |
操作2:向2mL NaHCO3溶液中滴加1mL 0.5molL﹣1CaCl2溶液 | 无白色沉淀 | Na2CO3溶液中的CO32﹣浓度很小,不能与CaCl2发生反应。 |
操作1反应的离子方程式为________________,实施试验后,发现操作2的现象与预测有差异,产生白色沉淀和气体,则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为____________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com