
科目: 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2+ +2OH- ![]() CH3COONH4 +3NH3+2Ag↓+H2O
CH3COONH4 +3NH3+2Ag↓+H2O
B. 苯酚钠溶液中通入少量CO2:CO2 +H2O+2C6H5O-→2C6H5OH+CO32-
C. 氯乙烷中滴入AgNO3溶液检验其中氯元素:Cl-+Ag+=AgCl↓
D. 乙酸滴入氢氧化铜悬浊液中:2CH3COOH+Cu(OH)2=Cu2++2CH3COO-+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科研人员以Zn和尖晶石型锰酸锌(ZnMn2O4)为电极材料,研制出一种水系锌离子电池。该电池的总反应方程式:xZn + Zn1xMn2O4![]() ZnMn2O4(0 < x < 1)。下列说法正确的是
ZnMn2O4(0 < x < 1)。下列说法正确的是
A. 充电时,Zn2+向ZnMn2O4电极迁移
B. 充电时,阳极反应:ZnMn2O4 2xe—=Zn1-xMn2O4+xZn2+
C. 放电时,每转移1mol e-,ZnMn2O4电极质量增加65g
D. 充放电过程中,只有Zn元素的化合价发生变化
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:① CH3CH=CHCH2CH3![]() CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH
② R-CH=CH2![]() R-CH2-CH2-Br
R-CH2-CH2-Br
香豆素的核心结构是芳香内酯A,A经下列步骤转变为水杨酸。

请回答下列问题:
(1)下列有关A、B、C的叙述中不正确的是__________
a.C中核磁共振氢谱共有8种峰 b.A、B、C均可发生加聚反应
c.1mol A最多能和5mol氢气发生加成反应 d.B能与浓溴水发生取代反应
(2)B分子中有2个含氧官能团,分别为_____和_____(填官能团名称),B→C的反应类型为____________。
(3)在上述转化过程中,反应步骤B→C的目的是________________________。
(4)化合物D有多种同分异构体,其中一类同分异构体是苯的对二取代物,且水解后生成的产物之一能发生银镜反应。请写出其中一种的结构简式:____________。
(5)写出合成高分子化合物E的化学反应方程式:______________________________。
(6)写出以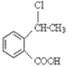 为原料制备
为原料制备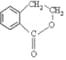 的合成路线流程图(无机试剂任用),并注明反应条件。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用),并注明反应条件。合成路线流程图示例如下:![]()
______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙醇分子中不同的化学键如右图,关于其在各类反应中断裂键的说明不正确的是
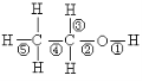
A. 和金属钠反应键①断裂
B. 和HBr在一定条件下反应时键②断裂
C. 和浓硫酸共热140℃时键①或键②断裂;170℃时键②③断裂
D. 在Ag催化下和O2反应键①③断裂
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素。A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子。
(1)基态的F3+核外电子排布式是____________________________________________。
(2)B的气态氢化物在水中的溶解度远大于A、C的气态氢化物,原因是______________。
(3)化合物FD3是棕色固体、易潮解、100 ℃左右时升华,它的晶体类型是______________;化合物ECAB中的阴离子与AC2互为等电子体,该阴离子的电子式是____________________。
(4)FD3与ECAB溶液混合,得到含多种配合物的血红色溶液,其中配位数为5的配合物的化学式是______________________________________________________________。
(5)化合物EF[F(AB)6]是一种蓝色晶体,下图表示其晶胞的![]() (E+未画出)。该蓝色晶体的一个晶胞中E+的个数为________。
(E+未画出)。该蓝色晶体的一个晶胞中E+的个数为________。

查看答案和解析>>
科目: 来源: 题型:
【题目】CO2是一种温室气体,据科学家预测,到21世纪中叶,全球气温将升高1.5~4.5 ℃,地球气温的升高会引起海平面升高,对人类的生存环境产生巨大的影响。如何合理地利用CO2是摆在科学家面前的一个重大课题。回答下列问题:
(1)工业上利用高温、高压条件,可用CO2与NH3合成尿素[CO(NH2)2],该反应的化学方程式为___。
(2)一定条件下,不同量的CO2与不同量的NaOH充分反应放出的热量如下表所示:
CO2的量 | NaOH溶液的量 | 放出的热量 | |
① | 22.0 g | 750 mL 1.0 mol·L-1 | x kJ |
② | 1.0 mol | 2.0 L 1.0 mol·L-1 | y kJ |
写出该条件下CO2与NaOH溶液反应生成NaHCO3的热化学方程式: ___________________。
(3)在一定温度和催化剂作用下,可将CO2转化为燃料CH4,反应方程式为CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g) ΔH。当300 ℃时,一定量的CO2和H2混合气体在容积为2 L的恒容密闭容器中发生上述反应,5 min后达到平衡,此时各物质的浓度如下表:
CH4(g)+2H2O(g) ΔH。当300 ℃时,一定量的CO2和H2混合气体在容积为2 L的恒容密闭容器中发生上述反应,5 min后达到平衡,此时各物质的浓度如下表:
物质 | CO2(g) | H2(g) | CH4(g) | H2O(g) |
浓度/mol·L-1 | 0.2 | 0.8 | a | 1.6 |
则平衡时容器中甲烷的物质的量n(CH4)=________。从反应开始到达到平衡时的化学反应速率v(CH4)=__________。500 ℃时该反应的平衡常数K=16,则该反应的ΔH__________(填“>”“<”)0。
(4)CO2还可用于生产甲醇,一定条件下,发生反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH。
CH3OH(g)+H2O(g) ΔH。
①在容积为2 L的恒容密闭容器中,通入2 mol CO2和3 mol H2发生上述反应,下列说法能够表明该可逆反应达到平衡状态的是__________(填字母)。
a.消耗3 mol H2(g)时,有1 mol CH3OH(g)生成
b.转移3 mol电子时,反应的CO2为11.2 L(标准状况)
c.体系中气体的密度不变
d.水蒸气的体积分数保持不变
e.单位时间内生成H2(g)与生成H2O(g)的物质的量之比为3∶1
②用多孔石墨作电极,30% KOH溶液作电解质溶液,可设计如图甲所示的甲醇燃料电池,该电池的负极反应式为______________________________。若将该燃料电池与电解饱和食盐水的装置进行串联(如图),当有0.12 mol 电子发生转移时,断开电源,将溶液冷却至室温,测得食盐溶液为120 mL,则此时乙装置中溶液的pH=________(假设食盐水中有足量的NaCl,且Cl2完全逸出)。
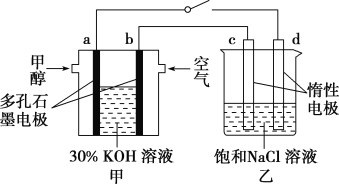
查看答案和解析>>
科目: 来源: 题型:
【题目】实验是化学研究的一种重要手段,现有图所示A-G七种仪器,请根据要求填空。

(I)写出仪器名称:F_________。
(II)下列实验操作中用到仪器G的是_______(选填下列选项的编号字母)。
a.分离水和CC14的混合物b.分离水和酒精的混合物c.分离水和泥砂的混合物
(III)配制480mL、0.2molL-1CuSO4溶液。
(1)应用托盘天平称取CuSO45H2O晶体____________,
(2)使用容量瓶前必须进行的一步操作是________,在容量瓶上需标记的是____________(填字母),
a.温度b.刻度线c.浓度d.容积
(3)所需仪器除了烧杯、玻璃棒、托盘天平外,还缺少__________________,
(4)实验中两次用到玻璃棒,起作用分别是____________、____________。
(5)配制溶液时除了称量、溶解、冷却、转移溶液、摇匀操作外,还缺少:__________________(填操作名称)。
(6)若实验中有下列情况,对配制溶液的浓度有何影响?(填“偏高”、“偏低”或“无影响”)
a.胆矾失去了部分结晶水____________;
b.定容时加水超过刻度线____________;
c.最终定容时仰视观察液面____________;
d.容量瓶不干燥,含有少量蒸馏水____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中,正确的是
A. 甲苯可以与液溴混合后加入铁粉生成![]()
B. 实验室制备乙烯时,温度计水银球应该插入浓硫酸和无水乙醇的混合液液面以下
C. 向溴乙烷中加入NaOH溶液加热,充分反应,再加入AgNO3溶液,产生淡黄色沉淀,证明溴乙烷中含有溴元素
D. 制备新制Cu(OH)2悬浊液时,将4~6滴2%的NaOH溶液滴入2mL2%的CuSO4溶液中,边滴边振荡
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)以下为中学化学中常见的几种物质:①二氧化碳②熔融KC1③NaHSO4固体④铜⑤稀硫酸⑥蔗糖⑦澄清石灰水,其中属于电解质的有_____________,属于非电解质的有__________________(填编号)。
(2)高铁酸钠(Na2FeO4)(铁为+6价)是一种新型的净水剂,可以通过下述反应制取:2Fe(OH)3+4NaOH+3NaC1O=2Na2FeO4+3NaCl+5H2O
①该反应中氧化剂是_____________(用化学式表示,后同),_____________元素被氧化,还原产物为_____________;
②当反应中有1molNaFeO4生成,转移的电子有_____________ mol;
③用单线桥法标出反应中电子转移的方向和数目。________
(3)配平该反应方程式:
______K2Cr2O7+______HCl═______KCl+______CrCl3+______Cl2↑+______H2O,
(4)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
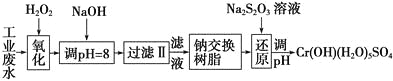
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.Na2O2B.HNO3C.FeCl3D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________;已知钠离子交换树脂的原理:Mn++nNaR―→MRn+nNa+,此步操作被交换除去的杂质离子是__________。
A.Fe3+B.Al3+C.Ca2+D.Mg2+
(3)还原过程中,每消耗0.8 mol Cr2O![]() 转移4.8 mol e-,该反应离子方程式为________________。
转移4.8 mol e-,该反应离子方程式为________________。
Ⅱ.酸性条件下,六价铬主要以Cr2O![]() 形式存在,工业上常用电解法处理含Cr2O
形式存在,工业上常用电解法处理含Cr2O![]() 的废水:
的废水:
该法用Fe作电极电解含Cr2O![]() 的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液。
的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液。
(1)电解时能否用Cu电极来代替Fe电极?________(填“能”或“不能”),理由是______________。
(2)电解时阳极附近溶液中Cr2O![]() 转化为Cr3+的离子方程式为___________________。
转化为Cr3+的离子方程式为___________________。
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为____时才能使c(Cr3+)降至10-5mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com