
科目: 来源: 题型:
【题目】(1)已知Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=2.6×10-39。常温下,某酸性CuCl2溶液中含有少量的FeCl3,为了得到纯净的CuCl2·2H2O晶体,应加入___________(填氧化物的化学式),调节溶液的pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等。水垢需及时清洗除去。清洗流程如下:
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸和少量NaF溶液,浸泡;
Ⅲ.向洗涤液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
①用稀盐酸溶解碳酸钙的离子方程式是_____________________________。
②已知:25 ℃时有关物质的溶度积
物质 | CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
Ksp | 2.8×10-9 | 9.1×10-6 | 1.8×10-11 | 6.8×10-6 |
根据数据,结合化学平衡原理解释清洗CaSO4的过程________________。(用溶解平衡表达式和必要的文字叙述加以说明);在步骤Ⅰ浸泡过程中还会发生反应MgCO3(s)+2OH-(aq)![]() Mg(OH)2(s)+CO32-(aq),该反应的平衡常数K=________(保留两位有效数字)。
Mg(OH)2(s)+CO32-(aq),该反应的平衡常数K=________(保留两位有效数字)。
③步骤Ⅲ中,加入Na2SO3溶液的目的是_______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生为了探究锌与盐酸反应过程中的速率变化,在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气。(实验记录的体积为累计值,已换算成标准状况):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大___,原因是___。
(2)哪一段时段的反应速率最小___,原因是___。
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)___。
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:
A.蒸馏水 B.NaCl溶液 C.NaNO3溶液D.Na2CO3溶液
你认为可行的是(填编号)___。
查看答案和解析>>
科目: 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀溶解平衡,它们都可看作化学平衡。请根据所学知识回答下列问题:
(1)AlCl3溶液呈______性(填“酸”“中”“碱”)原因是_________________________(用离子方程式表示);若把AlCl3溶液蒸干,灼烧,最后主要得到固体产物是________;若将AlCl3溶液和NaHCO3溶液混合,该反应的离子方程式为__________________________________________。
(2)将1L0.2 mol·L-1HA溶液与1L0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积变化忽略不计),测得混合溶液中c(Na+)>c(A-),则:
①混合溶液中,c(A-)________c(HA)(填“>”“<”或“=”,下同)。
②混合溶液中,c(HA)+c(A-)________0.1 mol·L-1。
(3)常温下,若NaOH溶液中c(OH—)与NH4Cl溶液中c(H+)相同,现将NaOH溶液和NH4Cl溶液分别稀释10倍,稀释后NaOH溶液和NH4CI溶液的pH分别用pH1和pH2表示。则pH1 +pH2________(填“>”“<”或“=”)14。
(4)pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】由A、B、C、D四种金属按下表中装置进行实验,根据实验现象填表:
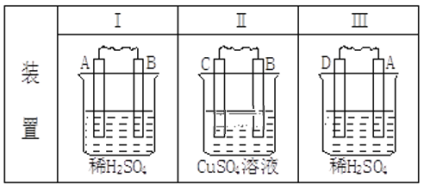
现象 | (I)金属A逐渐溶解 | (Ⅱ)C的质量增加 | (Ⅲ)A上有气体产生 |
填正极反应式 | ___ | ___ | |
四种金属活动性由强到弱的顺序:___。 | |||
若装置(Ⅲ)中A极产生的气体在标准状况下的体积为224mL,则通过导线中的电子的物质的量为___mol。 | |||
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分,根据表中序号对应元素回答有关问题:
族 周期 | IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ | ⑩ |
(1)表中元素,化学性质最不活泼的是___,只有负价而无正价的是___,原子半径最大的是___;(填写元素符号);
(2)表中能形成两性氢氧化物的元素是___(填元素符号),分别写出该元素的氢氧化物与⑥、⑨的最高价氧化物对应水化物反应的离子方程式分别是___、___。
(3)元素①组成的单质的电子式为___;用电子式表示⑥的氢化物的形成过程___。
(4)②和③的单质加热时反应生成物质X,其化学式为___,该物质中含有的化学键的类型为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列说法正确的有
① 3 mol单质Fe完全转化为Fe3O4,失去9NA个电子
② 标准状况下,11.2LCl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
③ 32gS8(分子结构:![]() )中的共价键数目为NA
)中的共价键数目为NA
④常温常压下,0.5 mol Fe和足量浓硝酸混合,转移电子数为1.5NA
⑤ 1L0.1mol·L-1 NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA
⑥浓硫酸(含1molH2SO4)与足量Cu加热发生反应生成0.5NA个SO2分子
⑦标准状况下,22.4 L N2和H2的混合气休中含有NA个原子
⑧23gNa与足量H2O反应完全后可生成NA个氢气分子
A. 一项B. 两项C. 三项D. 四项
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向浓度为0.1 mol·L-1、体积为V L的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题:

(1)该温度时NH3·H2O的电离常数K=________。
(2)滴定过程中所用盐酸的pH=________。
(3)比较b、c、d三点时的溶液中,由水电离出的c(OH-)大小顺序为___________。(填字母)
(4)滴定时,由b点到c点的过程中,下列各选项中数值变大的是___(填字母,下同)。
A.c(H+)·c(OH-) B. c(H+)·c(NH3·H2O)/c(NH4+)
C. c(NH4+)·c(OH-)/c(NH3·H2O) D. c(H+)/c(OH-)
(5)根据以上滴定曲线判断下列说法正确的是________(溶液中N元素只存在NH4+和NH3·H2O两种形式)。
A.点b所示溶液中:c(NH4+)+c(H+)=c(OH-)+c(NH3·H2O)
B.点c所示溶液中:c(Cl-)=c(NH3·H2O)+c(NH4+)
C.点d所示溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.滴定过程中可能有:c(NH3·H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+)
(6)d点之后若继续加入盐酸至图像中的e点(不考虑NH4+水解的影响),则e点对应的横坐标为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将a克Fe2O3、Al2O3样品溶解在过量的200mL pH=1的硫酸溶液中,然后向其中加入NaOH 溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH 溶液100 mL,则NaOH 溶液的浓度为
A. 0.1 mol/LB. 0.2 mol/LC. 0.4 mol/LD. 0.8 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,在体积为VL的固定容积的容器中发生反应:A(g)+B(g)![]() 3C(g)(正反应为放热反应)下列说法能说明该反应已经达到平衡状态的是( )
3C(g)(正反应为放热反应)下列说法能说明该反应已经达到平衡状态的是( )
①单位时间内生成C的分子数与分解C的分子数相等②外界条件不变时,ABC的浓度不随时间变化③体系温度不再变化④体系的分子总数不再变化 ⑤反应速率3v(B)=v(C)
A.①②B.①②③
C.①②③④D.①②③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】不同温度下,水溶液中c(H+)与c(OH-)的关系如图所示。下列有关说法不正确的是( )
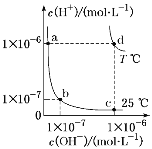
A. d点对应的食盐水pH=6,呈中性
B. 向a点对应的CH3COOH溶液中滴加NaOH溶液至b点,此时c(Na+)=c(CH3COO-)
C. a点对应的稀硫酸与c点对应的CH3COONa溶液中水的电离程度相同
D. 温度为T ℃时,0.05 mol·L-1Ba(OH)2溶液的pH=11
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com