
科目: 来源: 题型:
【题目】Ⅰ.运用已学知识完成下列计算:
(1)0.5 mol CH4的质量是________,在标准状况下的体积为________。
(2)3.1 g Na2X含有Na+ 0.1 mol,则X的相对原子质量为________。
Ⅱ.为防治碘缺乏病,通常在食盐中添加少量的碘酸钾(KIO3)。碘酸钾和碘化钾在溶液中能发生下列反应:KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O
(1)该反应中,氧化剂是________,氧化产物是_____。
(2)当有3mol I2生成时,有______mol还原剂被氧化。
(3)用双线桥表示该反应电子转移的方向和数目_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】无色的混合气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100mL甲气体经过如图所示实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为( )
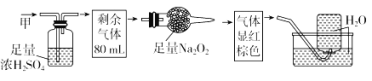
A. NH3、NO2、N2B. NH3、NO、CO2
C. NH3、NO2、CO2D. NO、CO2、N2
查看答案和解析>>
科目: 来源: 题型:
【题目】某铬盐厂生产过程中排出含Cr2O72-的工业酸性废水。为防止污染环境,现采用下列工艺流程进行处理后再排出。
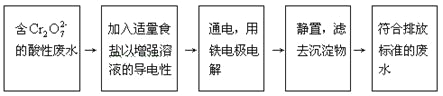
在整个处理过程中,Cr2O72-被还原为Cr3+,溶液的pH值逐渐升高,最后滤出的沉淀有Cr(OH)3和Fe(OH)3,试分析这个污水处理过程,回答:
(1)电解时,铁电极上的电极反应式:
阳极:__________________________________,
阴极:__________________________________。
(2)用铁(而不用炭)作电极进行电解的原因:__________________________。
(3)Cr2O72-在酸性环境中被还原剂还原,能除去Cr2O72-。减少溶液酸性是整个工艺流程中关键的一步,这个变化的离子方程式是____________。
(4)溶液的pH值逐渐增大的原因是______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如下图所示是中学化学中常用于混合物分离和提纯的装置:

请根据装置图回答下列问题:
(1)从氯化钾溶液中到氯化钾固体选择装置________(填代表装置图的字母,下同);除去粗盐中的泥沙,选择装置________。
(2)从碘水中分离出I2,选择装置________,该分离方法的名称为________。
(3)装置A中①的名称是________,冷凝水流动的方向是____________________。
(4)在用装置B进行操作时,为使液体顺利滴下,应进行的具体操作是_____________。分液后漏斗内剩余的液体从分液漏斗的________(填“上口”或“下口”)倒入烧杯。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室需要配制0.50 mol·L-1 NaOH溶液480 mL。按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、________、________。
(2)计算。配制该溶液需称取NaOH固体的质量为________g。
(3)称量。
(4)溶解、冷却。
(5)转移、洗涤。
①使用容量瓶前必须________________,容量瓶除注明规格外,还标有_______(选填编号),
a.温度 b.浓度 c.压强 d.刻度线,
②在转移时应使用玻璃棒引流,洗涤烧杯2~3次是为了_________________________。
(6)定容,摇匀。
(7)经精确测量,最后所得溶液物质的量浓度为0.192mol/L,原因可能是___________。
A.使用滤纸称量NaOH固体;
B.溶解NaOH后的烧杯未经多次洗涤;
C.容量瓶中原来有少量蒸馏水;
D.称量时所用的砝码生锈;
E.未冷却直接转移至容量瓶,立即配好;
查看答案和解析>>
科目: 来源: 题型:
【题目】现用18.4 mol/L的浓H2SO4来配制500 mL 0.2 mol/L的稀H2SO4。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥托盘天平 ⑦药匙。请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时不需要使用的有___________(填代号),还缺少的仪器是______________________。
(2)经计算,需浓H2SO4的体积为___________,量取浓硫酸时应选用___________(选填①10 mL、②50 mL、③100 mL三种规格)的量筒。
(3)将所配制的稀H2SO4进行测定,发现浓度大于0.2 mol/L。请你分析配制过程中可能引起浓度偏高的原因_____________________ (多选题)
A.定容时液面低于刻度线
B.未冷却到室温就定容
C.定容时液面高于刻度线
D.量取浓硫酸时俯视读数
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于Fe3+、Fe2+性质实验的说法错误的是

A. 用上图装置可以制备沉淀Fe(OH)2
B. 配制FeCl3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度
C. FeCl3溶液中滴加KSCN溶液会生成红色沉淀
D. 向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化
查看答案和解析>>
科目: 来源: 题型:
【题目】相等物质的量的CO和CO2相比较,下列有关叙述中正确的是( )。
①它们所含的分子数目之比为1∶1;②它们所含的O原子数目之比为1∶2;③它们所含的原子总数目之比为2∶3;④它们所含的C原子数目之比为1∶1;⑤它们的质量之比为7∶11
A.①②③④B.②和③C.④和⑤D.①②③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质,不能按如图(“→”表示反应一步完成)关系转化的是

选 项 | a | b | c |
A | Al2O3 | NaAlO2 | Al(OH)3 |
B | Al | Al(OH)3 | Al2O3 |
C | AlCl3 | Al(OH)3 | NaAlO2 |
D | MgCl2 | Mg(OH)2 | MgO |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A.氢氧化钠的摩尔质量是40 g
B.1 mol NaOH的质量是40 g/mol
C.1 g H2和1 g N2所含分子数相等
D.等物质的量的N2、CH4、CO、H2O中,所含分子数一样多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com