
科目: 来源: 题型:
【题目】FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性
Ⅰ.实验室制备FeBr2
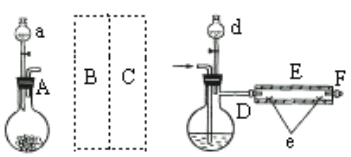
实验室用下图所示装置制取溴化亚铁.其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是两个耐高温的瓷皿,其中盛有细铁粉。
实验开始时先将铁粉加热至600℃~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,不断将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁。
请回答:
(1)若在A中盛固体CaCO3,a中盛6mol/L盐酸,B处是装有饱和NaHCO3溶液的洗气瓶为使导入D中的CO2为干燥纯净的气体,则图中C处的装置和其中的试剂应是:________,为防止污染空气,实验时应在F处连接盛________的尾气吸收装置。
(2)反应过程中要不断通入CO2,其主要作用有两个:①是利用CO2把反应器中空气赶尽;②是________.
Ⅱ.探究FeBr2的还原性
(1)实验需要90 mL 0.1 mol·L-1FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外还需的玻璃仪器是________。
(2)取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
设计实验证明假设2是正确的_______________________________
(3)实验证明:还原性Fe2+>Br-请用一个离子方程式来证明:_____________;
(4)若在40mL上述FeBr2溶液中通入3×10-3molCl2,则反应的离子方程式为:____________。
查看答案和解析>>
科目: 来源: 题型:
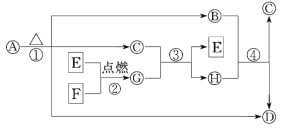
【题目】A~H为中学化学中常见的物质,转化关系如下所示,其中“O”代表化合物,“□”代表单质,A为医疗上治疗胃酸过多的一种药剂,G为淡黄色固体,C在通常状况下为无色液体.
请回答下列问题:
(1)G的化学式为________,每生成1 mol G转移电子________mol.
(2)反应①②③④中________(填序号)属于氧化还原反应.
(3)写出下列反应的化学方程式:A→B+C+D:_______________________________,F+C:________________________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】异丁酸-3-苯丙酯(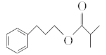 )是一种香料,下图是这种香料的一种合成路线:
)是一种香料,下图是这种香料的一种合成路线:
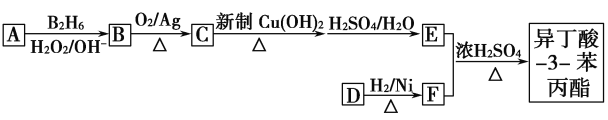
已知以下信息:
①有机物E的摩尔质量为88 g·mol-1,其核磁共振氢谱表明含有3种不同环境的氢原子。
②有机物F是苯甲醇的同系物。
③R—CH==CH2![]() R—CH2CH2OH。
R—CH2CH2OH。
请回答下列问题:
(1)异丁酸-3-苯丙酯的分子式为________________。
(2)A分子中的官能团名称为________________。
(3)C的结构简式为________________。
(4)一定条件下,1 mol D与2 mol H2能够完全反应生成F,D能够发生银镜反应,因此D生成F的反应类型为________________。
(5)E、F反应生成异丁酸-3-苯丙酯的化学方程式为________________________。
(6)已知有机化合物甲符合下列条件:
①与F是同分异构体;②苯环上有3个支链;③核磁共振氢谱显示其含有5种不同环境的氢原子,且不同环境的氢原子个数比为6∶2∶2∶1∶1;④与FeCl3溶液不能发生显色反应。
写出符合上述条件的有机物甲的结构简式:_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺流程如下:

已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe2+、Al3+、Ca2+和Mg2+。②Cr2O72-+H2O![]() 2CrO42-+2H+。③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
2CrO42-+2H+。③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe2+ | Mg2+ | Al3+ | Cr3+ |
沉淀完全时的pH | 3.2 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1) 实验室用18.4mol/L的浓硫酸配制480mL2mol/L的硫酸,需量取浓硫酸_____mL;配制时除量筒、烧杯和玻璃棒外,还需用到的玻璃仪器有______________。
(2) H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:__________。
(3过滤II操作得到的滤渣主要为______(填化学式),滤液II中含有的离子主要有__。
(4) 钠离子交换树脂的反应原理为:Mn++nNaR=MRn+nNa+,则利用钠离子交换树脂可除去滤液II中的金属阳离子有_______________。
(5) 写出上述流程中用SO2进行还原时发生反应的离子方程式__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如下转化关系(其他产物已略去)。下列说法不正确的是
![]()
A. 若W是单质铁,则Z溶液可能是FeCl2溶液
B. 若W是氢氧化钠,则X与Z可反应生成Y
C. 若X是金属镁,则W可能是强氧化性的单质
D. 若X是金属Na,则Z可以是Na2O2
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ有反应:![]() 。
。
(1)________元素的化合价升高,则该元素的原子________电子,被________(填“氧化”或“还原”);而________元素的化合价降低,则该元素的原子________电子,被________(填“氧化”或“还原”)。
(2)该反应中Fe2O3发生了________反应,Al发生了________反应;______是氧化剂,______ 是还原剂,______是氧化产物,_____是还原产物。
Ⅱ.已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):![]()
试通过计算和推理完成下面的问题:
(1)A物质可以导致酸雨的形成。A应该属于________(填字母)。
a.酸 b.碱 c.盐 d.酸性氧化物 e.碱性氧化物
(2)A物质可以使酸性KMnO4溶液褪色,此反应中(填化学式,下同)________失去电子,氧化剂是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上利用无机矿物资源生产部分材料的流程示意图如下。下列说法正确的是( )
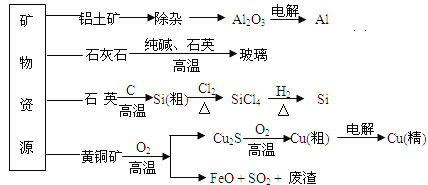
(注:铝土矿中含有A12O3、SiO2、Fe2O3)
A. 在铝土矿制备较高纯度A1的过程中只用到NaOH溶液、CO2气体、冰晶石
B. 石灰石、纯碱、石英、玻璃都属于盐,都能与盐酸反应
C. 在制粗硅时,氧化剂与还原剂的物质的量之比为1∶2
D. 黄铜矿(CuFeS2)与O2反应产生的Cu2S、SO2均是还原产物
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学教师为 “氯气与金属钠反应”设计了如图装置的实验。实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述中错误的是( )

A. 反应生成的大量白烟是氯化钠晶体
B. 玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气
C. 钠着火燃烧产生苍白色火焰
D. 发生的反应为2Na+Cl2![]() 2NaCl
2NaCl
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于氧化还原反应的叙述正确的是
A.H2还原CuO的反应只属于还原反应
B.置换反应都是氧化还原反应,所以,![]() 既是置换反应又是氧化还原反应
既是置换反应又是氧化还原反应
C.![]() 是氧化还原反应
是氧化还原反应
D.复分解反应一定不是氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com