
科目: 来源: 题型:
【题目】根据物质结构有关性质和特点,回答下列问题:
(1)基态As原子的价层电子的电子云轮廓图形状为_____________。
(2)Na3AsO3可用于碘的微量分析。Na3AsO3中所含阴离子的立体构型为_____________,写出一种与其互为等电子体的分子:_____________(填化学式)。
(3)丙烯腈(CH2=CH-CN)分子中碳原子轨道杂化类型是____________。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为___________。区分晶体Ni和非晶体Ni的最可靠的科学方法为___________。
(5)钛存在两种同素异形体,α—Ti采纳六方最密堆积,β—Ti采纳体心立方堆积,由α—Ti转变为β—Ti晶体体积____________(填“膨胀”或“收缩”)。
(6)某镍白铜合金的立方晶胞结构如图所示。若合金的密度为d g·cm-3,晶胞参数a=______ nm。

查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
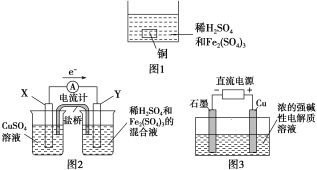
A. 如图1所示将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合溶液中,若铜片完全溶解时(不考虑盐的水解及溶液体积的变化),溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶液中c(SO![]() )为0.5 mol/L
)为0.5 mol/L
B. 如图2所示的装置中发生Cu+2Fe3+===Cu2++2Fe2+的反应,X极是负极,Y极的材料可以是铜
C. Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图3所示,石墨电极上产生氢气,铜电极发生还原反应
D. 如图3所示当有0.1 mol电子转移时,有0.1 mol Cu2O生成
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)①标准状况下,1g氢气和14g氮气的体积相同
②常温常压下,16g氧气和臭氧的混合气体中含有的质子数为8NA
③0.1L 0.5mol/LCH3CH2OH溶液中含有氢原子数为0.3NA
④常温常压下,28gCO的体积大于22.4L
⑤分子总数相等的NO2和CO2,所含氧原子数均为2NA
上述表述中正确的有:_______
(2)用容量瓶配制溶液时,由于操作不当会引起误差
①用天平称量时所用砝码生锈
②用量筒量取所需浓溶液时,仰视刻度
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,俯视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
上述情况会使所配溶液浓度偏低的是 :_______
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)0.5molCH4含______个电子。
(2)下列物质既能导电,又属于电解质的是_______ 。
A NaCl溶液 B 铁丝 C 稀硫酸 D 熔融的氢氧化钠 E 盐酸 F 硫酸
(3)同温同压下,甲容器中HCl气体和乙容器中的NH3所含原子个数相等,则甲乙两容器的体积之比为________。
(4)现配制500ml 0.3mol/L稀硫酸溶液,需用量筒量取质量分数为49%,密度为1.5g/cm3的浓硫酸 _________ml。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关电化学装置的说法正确的是
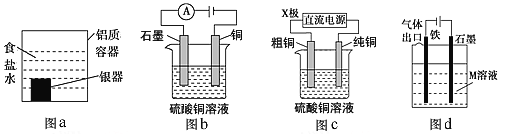
A. 利用图a装置处理银器表面的黑斑Ag2S,银器表面的反应为Ag2S+2e-=2Ag+S2-
B. 图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出
C. 图c中的X极若为负极,则该装置可实现粗铜的精炼
D. 图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学结合所学知识探究Na2O2与H2能否反应,设计装置如下,下列说法正确的是( )
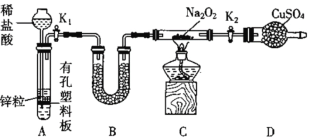
A.若D中无水硫酸铜变蓝,则说明Na2O2与H2反应生成水
B.装置B中盛放浓硫酸,目的是除去A中挥发出来的少量水蒸气
C.装置C加热前,用试管在干燥管管口处收集气体点燃,通过声音判断气体纯度
D.装置A也可直接用于二氧化锰与浓盐酸反应制取氯气
查看答案和解析>>
科目: 来源: 题型:
【题目】将图Ⅰ所示装置通电10 min后,撤掉直流电源,连接成图Ⅱ所示装置,可观察到U形管左侧铁电极表面析出了白色胶状物质,U形管右侧液面上升。下列说法正确的是( )

A. 同温同压下,装置Ⅰ中石墨电极上方得到的气体比铁电极上方得到的气体多
B. 装置Ⅱ中铁电极的电极反应式为Fe-2e-+2OH-===Fe(OH)2↓
C. 装置Ⅱ中石墨电极的电极反应式为2H++2e-===H2↑
D. 装置Ⅰ通电10 min后,铁电极附近溶液的pH降低
查看答案和解析>>
科目: 来源: 题型:
【题目】将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸的体积有如图所示的关系(不考虑CO2在水中的溶解)。下列说法不正确的是( )
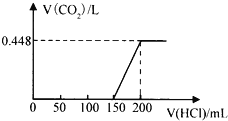
A. 滴加盐酸0→150mL段发生的反应依次为OH-+H+=H2O、CO32-+H+=HCO3-
B. 所用盐酸的物质的量浓度为0.4 molL﹣1
C. CO2体积不再改变时,溶液中的溶质为NaCl
D. 该样品中NaOH与Na2CO3物质的量之比为1:2
查看答案和解析>>
科目: 来源: 题型:
【题目】有一种新型的乙醇电池,它用磺酸类质子溶剂,在200 ℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为C2H5OH+3O2===2CO2+3H2O,电池示意如图,下列说法不正确的是( )

A. a极为电池的负极
B. 电池工作时,电流由b极沿导线经灯泡再到a极
C. 电池正极的电极反应为4H++O2+4e-===2H2O
D. 电池工作时,1 mol乙醇被氧化时就有6 mol电子转移
查看答案和解析>>
科目: 来源: 题型:
【题目】甲烷是一种重要的化工原料和清洁能源,研究其再生及合理利用有重要意义。
请回答:
(1)已知一定条件下发生如下反应:CO2(g)+2H2O(g)![]() CH4(g)+2O2(g) △H=+802kJ·mol-1。将一定量的CO2(g)和H2O(g)充入10L密闭容器中,分别在催化剂M、N的作用下发生上述反应,CH4(g)的产量(n)与光照时间(t)和温度(T)变化的关系如图1所示。
CH4(g)+2O2(g) △H=+802kJ·mol-1。将一定量的CO2(g)和H2O(g)充入10L密闭容器中,分别在催化剂M、N的作用下发生上述反应,CH4(g)的产量(n)与光照时间(t)和温度(T)变化的关系如图1所示。
①若甲烷的燃烧热(△H)为-890kJ·mol-1,则水的汽化热△H=___________。(汽化热指1mol液体转化为气体时吸收的热量)
②T1℃、催化剂M作用下,0~20h内该反应速率v(H2O)=___________,该反应的平衡常数表达式K=___________
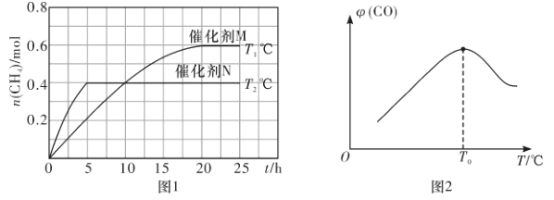
③根据图1判断,T1___________T2(填“>”“<”或“=”),理由为___________。
催化剂的催化效果:M___________N(填“强于”或“弱于”)。
(2)甲烷可用于制备合成气:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H。将CH4(g)和H2O(g)以物质的量之比为1:3充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数(
CO(g)+3H2(g) △H。将CH4(g)和H2O(g)以物质的量之比为1:3充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数(![]() )与温度(T)的关系如图2所示。T0℃时,CO的体积分数最大的原因为_________________________________。该反应的△H_______0(填“>”“<”)
)与温度(T)的关系如图2所示。T0℃时,CO的体积分数最大的原因为_________________________________。该反应的△H_______0(填“>”“<”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com