
科目: 来源: 题型:
【题目】(一)写出下列反应的化学方程式:
(1)实验室制乙烯__________________________________
(2)用甲苯制备TNT________________________________
(3)苯酚和浓溴水的反应_____________________________
(4)1,2-二溴乙烷与其足量氢氧化钠的乙醇溶液加热:____________________________
(5)乙醛与银氨溶液的反应____________________________
(二)(1)根据系统命名法,![]() 的名称是_________________
的名称是_________________![]() 的名称是_________________________________________________;
的名称是_________________________________________________;
(2) 顺-2-丁烯的结构简式是________________
(3)已知:室温下H2YO3的电离平衡常数Ka1=1.4×10-2,Ka2=6.3×10-8,NaHYO3溶液中离子浓度从大到小的顺序是_________________________________
(4) 某同学取出10 mL 0.010 mol·L-1氨水,用pH试纸测其pH=a,然后用蒸馏水稀释至1 000 mL,再用pH试纸测其pH=b,若要确认NH3·H2O是弱电解质,则a、b值应满足的关系是________。
(5)25 ℃时,将a mol·L-1氨水与0.01 mol·L-1盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入350mL 2molL﹣1的稀硝酸恰好使混合物完全溶解,放出2.24L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为( )
A. 0.21 molB. 0.25 molC. 0.3 molD. 0.35 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学采用工业大理石(含有少量SiO2、Al2O3、Fe2O3等杂质)制取CaCl2·6H2O,设计了如下流程:
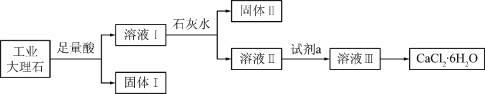
下列说法不正确的是
A. 固体I中含有SiO2,固体II中含有Fe(OH)3
B. 使用石灰水时,要控制pH,防止固体II中Al(OH)3转化为AlO2-
C. 试剂a选用盐酸,从溶液III得到CaCl2·6H2O产品的过程中,须控制条件防止其分解
D. 若改变实验方案,在溶液I中直接加氨水至沉淀完全,滤去沉淀,其溶液经蒸发浓缩、冷却结晶也可得到纯净CaCl2·6H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量占世界第一。从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:2Sb2S3+3O2+6Fe=Sb4O6+6FeS①;Sb4O6+6C=4Sb+6CO②。下列说法正确的是( )
A. 反应②说明高温下Sb还原性比C强
B. 反应①中每生成1 mol FeS时,共转移2mol电子
C. 每生成1 mol Sb时,反应①与反应②中还原剂的物质的量之比为4︰3
D. 反应①②中氧化剂分别是Sb2S3、Sb4O6
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组在实验室制取漂白粉,并探究氯气与石灰乳反应的条件和产物。
已知:①二氧化锰与浓盐酸反应可制备氯气,同时生成MnCl2;
②氯气和碱的反应为放热反应。温度较高时,氯气和碱还能发生如下反应:3Cl2+6NaOH ![]() 5NaCl+NaClO3+3H2O
5NaCl+NaClO3+3H2O
该兴趣小组设计了下列实验装置,进行实验。
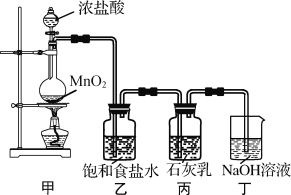
请回答下列问题:
(1)①甲装置用于制备氯气,乙装置的作用是____。
②实验室用足量NaOH溶液吸收从浓盐酸和MnO2反应体系中导出的气体。当吸收温度不同时,生成的产物可能是NaClO、NaClO3、NaCl中的两种或三种。下列说法不正确的是___。(填字母)
A.若产物为NaClO3、NaCl,则参加反应的氧化剂和还原剂的物质的量之比为1∶5
B.若产物为NaClO、NaCl,则吸收后的溶液中n(NaClO)=n(NaCl)
C.若产物为NaClO、NaClO3、NaCl,则NaOH与Cl2相互反应的物质的量之比为2∶1
(2)小组成员发现,产物中Ca(ClO)2的质量明显小于理论值。他们讨论后认为,其可能原因是部分氯气未与石灰乳反应而逸出,以及温度升高。为了探究反应条件对产物的影响,他们另取一定量的石灰乳,缓慢匀速地通入足量氯气,得出了Ca(ClO)2、Ca(ClO3)2两种物质的物质的量(n)与反应时间(t)的关系曲线,粗略表示为下图(不考虑氯气和水的反应)。
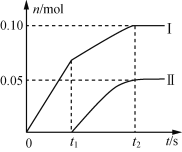
①图中曲线II表示___(填物质的化学式)的物质的量随反应时间变化的关系;
②所取石灰乳中含有Ca(OH)2的物质的量为___mol;
(3)为了提高Ca(ClO)2的产率,可对丙装置作适当改进。请你给出一种改进方法___。
查看答案和解析>>
科目: 来源: 题型:
【题目】用电解法处理含Cr2O72-的废水,探究不同因素对含Cr2O72-废水处理的影响,结果如表所示(Cr2O72-的起始浓度、体积、电压、电解时间均相同)。下列说法错误的是
实验 | i | ii | iii | iv |
|
是否加入Fe2(SO4)3 | 否 | 否 | 加入30g | 否 | |
是否加入H2SO4 | 否 | 加入1mL | 加入1mL | 加入1mL | |
阴极村料 | 石墨 | 石墨 | 石墨 | 石墨 | |
阳极材料 | 石墨 | 石墨 | 石墨 | 铁 | |
Cr2O72-的去除率 | 0.092% | 12.7% | 20.8% | 57.3% | 实验iii中Fe3+去除Cr2O72-的机理 |
A. 实验ⅱ与实验i对比,其他条件不变,增加c(H+)有利于Cr2O72-的去除
B. 实验ⅲ与实验ⅱ对比,其他条件不变,增加c(Fe3+)有利于Cr2O72-的去除
C. 实验ⅳ中Fe2+循环利用提高了Cr2O72-的去除率
D. 若实验ⅳ中去除0.01 mol Cr2O72-,生成的阳离子全部转化成沉淀,则沉淀的质量是2.06g
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为两套实验装置。
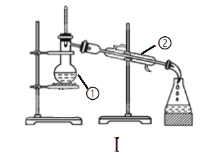
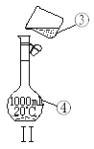
(1)写出下列仪器的名称:
①____;②___ 。
(2)仪器①~④中,使用时必须检查是否漏水的有____。(填序号)
(3)若利用装置I制取蒸馏水,还缺少的仪器是____。
(4)实验室欲使用480mL0.2mol·L-1 CuSO4溶液,配制该溶液包含以下步骤:
A.称取一定质量胆矾(CuSO4·5H2O)放入烧杯,用适量蒸馏水将其完全溶解;
B.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液都转入容量瓶中,并轻轻摇匀;
C.继续向容量瓶中加蒸馏水至凹液面距刻度线1~2cm时,改用胶头滴管滴加,直到溶液的凹液面恰好与刻度线相切为止;
D.把溶液小心地注入容量瓶中;
E.将容量瓶塞好充分摇匀。
请填写下列空白:
①用托盘天平称量胆矾,应该称取的质量是___。
②上述操作的正确顺序是___。
③实验用到的仪器有托盘天平(砝码)、药匙、烧杯、玻璃棒、胶头滴管、___等,玻璃棒的作用是___。
④下列情况中会导致所配溶液浓度偏小的是___(填序号)。
a.容量瓶使用前未干燥
b.转移溶液后,烧杯没有洗涤
c.定容过程观察容量瓶内液面时,俯视刻度线
d.颠倒摇匀后,发现液面低于刻度线,不作任何处置
e.加蒸馏水时不慎超过刻度线,用滴管小心地吸去超出部分,使液面与刻度线相切
查看答案和解析>>
科目: 来源: 题型:
【题目】乙酸松油酯是松油醇的酯化产物,具有甜香气味,广泛应用于日用和食用香精中。乙酸松油酯的结构简式如图甲所示,下列说法正确的是

A. 乙酸松油酯的分子式为C12H22O2
B. 乙酸松油酯的水解产物松油醇与图乙所示物质互为同分异构体
C. 乙酸松油酯既易溶于水、也易溶于乙醇或油脂
D. 乙酸松油酯能使Br2的CCl4溶液或酸性KMnO4溶液褪色
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)海水中蕴含的元素有80多种,它是一个巨大的宝藏。
①海水中被称为海洋元素是___。(填元素名称)
②下列物质不经过化学变化就能从海水中获得的是___。(填字母)
A.单质钠 B.单质碘 C.氯化钠
③加碘食盐中碘酸钾的化学式是___。
(2)实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
①在该反应的化学方程式上用双线桥标出电子转移的方向和数目___。
②该反应中浓盐酸表现的性质有___。
③如反应中转移了20mol电子,则产生的Cl2在标准状况下体积为__ L。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学实验小组用如图所示装置制取氯气,下列说法不正确的是
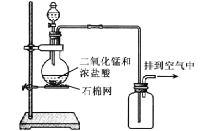
A.为了防止氯气污染空气,必须进行尾气处理
B.该装置图中存在两处明显错误
C.该实验装置中收集氯气的方法不正确
D.在集气瓶的导管口处放一片湿润的淀粉碘化钾试纸可以检验是否有氯气逸出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com