
科目: 来源: 题型:
【题目】有一可逆反应:2A(g)+3B(g) ![]() xC(g)+4D(g),若按下列两种配比在同温同体积的密闭容器中进行反应:①0.8 mol A+1.2 mol B+1.2 mol C+2.4 mol D②1.4 mol A+2.1 mol B+0.6 mol C+1.2 mol D达平衡后,C的质量分数相等,则方程式中x的值为( )
xC(g)+4D(g),若按下列两种配比在同温同体积的密闭容器中进行反应:①0.8 mol A+1.2 mol B+1.2 mol C+2.4 mol D②1.4 mol A+2.1 mol B+0.6 mol C+1.2 mol D达平衡后,C的质量分数相等,则方程式中x的值为( )
A. 1B. 2C. 3D. 4
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求写出方程式。
(1)铁和稀硫酸(写出离子方程式)___;
(2)氢氧化钡溶液和稀硫酸(写出离子方程式)__;
(3)氧化铜和稀盐酸(写出离子方程式)__;
(4)制备氢氧化铁胶体(写出对应的化学方程式)___;
(5)CO32-+2H+=CO2↑+H2O(写出对应的化学方程式)__。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知可逆反应:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
A. 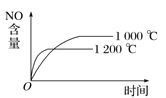 B.
B. 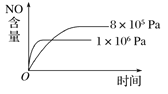
C. 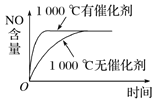 D.
D. 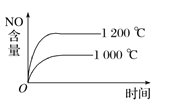
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.常温常压下,11.2L二氧化碳含有的原子数等于1.5NA
B.标准状况下,22.4LCCl4中所含分子数为NA
C.标准状况下,18g水所含原子数为NA
D.常温常压下,48gO2与O3混合物含有的氧原子数为3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】反应mX(g)![]() nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示,下列说法错误的是( )
nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示,下列说法错误的是( )

A. 该反应的ΔH>0
B. m<n+p
C. B、C两点化学平衡常数:KB>KC
D. A、C两点的反应速率v(A)<v(C)
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定质量的Mg-Al合金投入100mL一定物质的量浓度的某HCl溶液中,充分反应。向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如下图。回答下列问题:

(1)写出OA段和BC段反应的离子方程式:
OA:___________ ; BC:_____________;
(2)原Mg-Al合金的质量是_____________。
(3)原HCl溶液的物质的量浓度是________________。
(4)所加NaOH溶液的物质的量浓度是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.实验室要配制500 mL 0.2 mol/L NaOH溶液,请回答下列问题:
(1)配制过程中不需要使用的化学仪器有________(填字母)。
A 烧杯 B 500 mL容量瓶 C 漏斗 D 胶头滴管 E 玻璃棒
(2)用托盘天平称取氢氧化钠,其质量为________ g。
(3)下列主要操作步骤的正确顺序是________(填序号)。
①称取一定质量的氢氧化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶瓶颈刻度线下1~2 cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③待冷却至室温后,将溶液转移到500 mL容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
(4)如果实验过程中缺少步骤⑤,会使配制出的NaOH溶液浓度_______(填“偏高、偏低”或“不变”)。
Ⅱ.如图实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
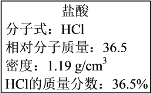
(1)该浓盐酸中HCl的物质的量浓度为______ mol/L。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是______。
A 溶液中HCl的物质的量 B 溶液的浓度
C 溶液中Cl-的数目 D 溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol/L的稀盐酸。该学生需要量取______mL上述浓盐酸进行配制。
Ⅲ.现有0.27Kg质量分数为10%的CuCl2溶液,则溶液中CuCl2的物质的量为___________
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g)![]() Z(g) ΔH<0,反应经60 s达到平衡并生成0.3 mol Z,则下列说法中正确的是( )
Z(g) ΔH<0,反应经60 s达到平衡并生成0.3 mol Z,则下列说法中正确的是( )
A. 其他条件不变,升高温度逆反应速率加快,正反应速率减慢
B. 其他条件不变,将容器体积扩大至20 L,则Z的平衡浓度变为原来的![]()
C. 其他条件不变,将容器体积缩小至5 L,平衡正向移动,平衡常数增大
D. 以Y浓度变化表示的反应速率为0.000 5 mol·L-1·s-1
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)K2Cr2O7+14HCl═2KCl+2CrCl3+3Cl2↑+7H2O氧化剂是______,氧化产物与还原产物的物质的量之比为_______。
(2)将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量之比为3∶2, 完成下列化学方程式(横线上填系数,括号内填物质):① ___KMnO4+____K2S+______===___K2MnO4+___K2SO4+___S↓+______。
② 若生成6.4g单质硫,反应过程中转移电子的物质的量为___。
(3)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染,化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气),若反应中消耗Cl2 1.5mol则被氧化的NH3在标准状况下的体积为____ L。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定量的混合气体在密闭容器中发生反应:mA(g)+nB(g)![]() pC(g)。达到平衡时,维持温度不变,将气体体积缩小到原来的1/2,当达到新的平衡时,气体C的浓度变为原平衡时的1.9倍。则下列说法正确的是( )
pC(g)。达到平衡时,维持温度不变,将气体体积缩小到原来的1/2,当达到新的平衡时,气体C的浓度变为原平衡时的1.9倍。则下列说法正确的是( )
A. m+n>pB. m+n<p
C. 平衡向正反应方向移动D. C的质量分数增加
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com