
科目: 来源: 题型:
【题目】阿伏加德罗常数为NA,下列说法正确的是( )
A.1mol钠与足量氧气反应,生成氧化钠和过氧化钠的混合物,转移的电子数为NA
B.通常状况下,NA个CO2分子的体积是22.4L
C.100ml0.1mol/L的H2SO4溶液中H+的个数是0.2NA
D.若1gN2含有m个分子,则NA=m/28
查看答案和解析>>
科目: 来源: 题型:
【题目】回答下列问题
(1)配平以下方程式
__K2Cr2O7+__HC1=__KC1+__CrCl3+__H2O+__Cl2↑
(2)以上反应中失电子的物质是__,还原产物是__,每生成lmol这种还原产物,将有__mol电子发生转移。氧化剂与还原剂的物质的量之比为___。
(3)已知反应:2H2S+H2SO3=2H2O+3S↓,若氧化产物比还原产物多1.6g,则同时会生成水的质量为___g。
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2的资源化利用能有效减少CO2排放,充分利用碳资源。
(1)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol1
C(s)+![]() O2(g)===CO(g) ΔH=-111 kJ·mol1
O2(g)===CO(g) ΔH=-111 kJ·mol1
①该催化重整反应的ΔH=____ kJ·mol1。有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
②某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为______mol2·L2。下列可判断该反应达到平衡的是_________(填标号)。
A.单位时间内生成n mol的CH4,同时生成n mol的H2 B.v(CH4):v(CO)=1:2
C.容器中混合气体的密度不再发生变化 D.容器中的压强保持不变
(2)CO2可以被(NH4)2CO3溶液捕获,反应为(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq) ΔH。为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,其关系如图1,则ΔH______(填“>”、“=”或“<”)0。
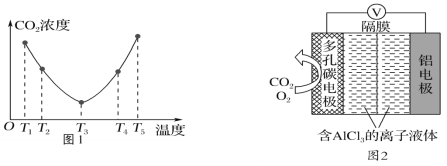
(3)O2辅助的Al-CO2电池工作原理如图2所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
电池的负极反应式:________________________________。
电池的正极反应式:6O2+6e-=6O;6CO2+6O=3C2O42-+6O2
反应过程中O2的作用是_________________。
(4)CO2可以被NaOH溶液捕获。若所得溶液c(HCO3-):c(CO32-) = 2∶1,溶液pH=________。(室温下,H2CO3的K1=4×10-7;K2=5×10-11)
查看答案和解析>>
科目: 来源: 题型:
【题目】乙醛酸(![]() )是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图所示。该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。下列说法不正确的是
)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图所示。该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。下列说法不正确的是
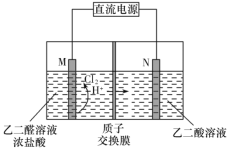
A. 若有2 mol H+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为2 mol
B. M电极上的电极反应式为:2Cl 2e =Cl2↑
C. 电解一段时间后,N极附近溶液的pH变大
D. M极与电源的负极相连
查看答案和解析>>
科目: 来源: 题型:
【题目】用于提纯或分离物质的方法有:A、萃取分液 B、加热分解 C、蒸发结晶 D、分液 E、蒸馏 F、过滤 G、渗析等,请将提纯或分离的序号填在后面横线上。
(1)分离饱和食盐水与泥沙的混合物___,
(2)精制Fe(OH)3胶体![]() 含有NaCl溶液
含有NaCl溶液![]() ___,
___,
(3)分离相溶的CCl4(沸点为76.75℃)和甲苯(110.6℃)的混合物___,
(4)从碘水里提取碘____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质结构和性质的说法不正确的是
A. 三联苯![]() 与四联苯
与四联苯![]() 互为同系物
互为同系物
B. 分子式为C5H10且与乙烯互为同系物的结构共有5种
C. 可用燃烧法鉴别环己烷、苯、CCl4
D. 分子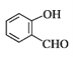 中所有原子可能位于同一平面
中所有原子可能位于同一平面
查看答案和解析>>
科目: 来源: 题型:
【题目】孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:
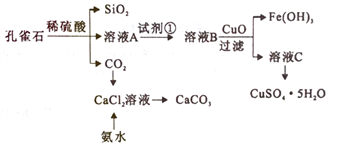
下列说法正确的是
A. 为将溶液A中的Fe2+氧化为Fe3+,试剂①可选用双氧水、氯气等
B. 流程中所加的CuO可以用Cu代替
C. 由溶液C获得CuSO4·5H2O,需要经过蒸发浓缩、冷却结晶、过滤、洗涤等操作
D. 制备CaCO3时,应向CaCl2溶液中先通入CO2,再加入氨水
查看答案和解析>>
科目: 来源: 题型:
【题目】下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是
|
|
|
|
A.4.03米大口径碳化硅反射镜 | B.2022年冬奥会聚氨酯速滑服 | C.能屏蔽电磁波的碳包覆银纳米线 | D.“玉兔二号”钛合金筛网轮 |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】硅酸钠被国家列为“我国优先发展的精细化学品”和“今后我国无机化工产品发展重点”之一。下图是用海边的石英砂(含氯化钠、氧化铁等杂质)制备硅酸钠的工艺流程示意简图:
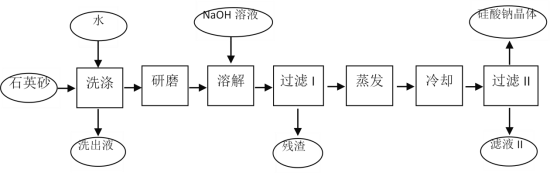
(1)要将洗出液中的溶质析出,采用的方法是_________。
A.蒸发结晶 B.冷却结晶
C.先蒸发,再冷却结晶 D.先冷却,再蒸发结晶
(2)在以上流程中,要将洗净的石英砂研磨成粉末,目的是_____________________________。
(3)蒸发时用到的硅酸盐仪器有____________________________________________________。
(4)上述流程中加入NaOH溶液,反应的离子方程式是_______________________________。
(5)硅酸钠溶液呈____性,硅酸钠的用途很广,其中的一种用途是_______________________。
(6)将用上流程中的残渣来焊接铁轨,反应的化学方程式是___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知2SO2 (g)+O2 (g)![]() 2SO3 (g) ΔH=-197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2 ;(丙) 2 mol SO3 。恒温、恒容下反应达平衡时,下列关系一定正确的是( )
2SO3 (g) ΔH=-197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2 ;(丙) 2 mol SO3 。恒温、恒容下反应达平衡时,下列关系一定正确的是( )
A. 容器内压强p:p甲=p丙>2p乙
B. SO3的质量m:m甲=m丙>2m乙
C. c(SO2)与c(O2)之比为k:k甲=k丙>k乙
D. 反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com