
科目: 来源: 题型:
【题目】A和B两种有机物可以互溶,有关性质如下:
物质 | 密度(g·cm-3) | 熔点/℃ | 沸点/℃ | 溶解性 |
A | 0.7893 | -117.3 | 78.5 | 与水以任意比混溶 |
B | 0.7137 | -116.6 | 34.5 | 不溶于水 |
(1)要除去A和B的混合物中的少量B,可采用的_______________方法可得到A。
A.蒸馏 B.重结晶 C.萃取 D.加水充分振荡,分液
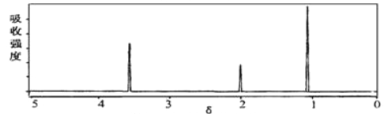
(2)将有机物A置于氧气流中充分燃烧,A和氧气恰好完全反应且消耗6.72L(标准状况)氧气,生成5.4gH2O和8.8gCO2,则该物质的实验式是__________;质谱图显示,A的相对分子质量为46,又已知有机物A的核磁共振氢谱如图所示,则A的结构简式为________________。
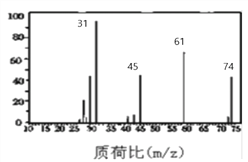
(3)下图是B的质谱图,则其相对分子质量为 ________ ,
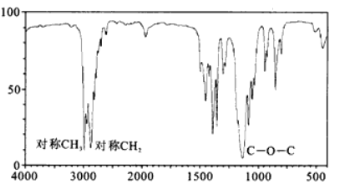
(4)B的红外光谱如图所示,则B的结构简式为__________________________。
(5)准确称取一定质量的A和B的混合物,在足量氧气充分燃烧,将产物依次通过足量的无水氯化钙和碱石灰,发现质量分别增加14.4g和26.4g。计算混合物中A和B的物质的量之比_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】4.35g二氧化锰与浓盐酸(密度为1.19gcm﹣3、质量分数为36.5%)完全反应.求:
(1)浓盐酸的物质的量浓度为多少?_______
(2)将所得气体全部用石灰乳吸收,可得到漂白粉的质量.________
查看答案和解析>>
科目: 来源: 题型:
【题目】氟碳铈矿(主要成分为CeFCO3)是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图所示。回答下列问题:

(1)CeFCO3中Ce的化合价为___________。
(2)氧化培烧时不能使用陶瓷容器,原因是_____________________________________。
(3)氧化焙烧后的产物之一为CeO2,则酸浸时发生反应的离子方程式为____________。
(4)HT是一种难溶于水的有机溶剂,则操作Ⅰ的名称为_________。
(5)为了提高酸浸率,可以适当提高反应温度,但温度偏高浸出率反而会减小,其原因是_______________________________________。
(6)有机物HT能将Ce3+从水溶液中提取出来,该过程可表示为Ce3+ (水层)+3HT(有机层) ![]() CeT3 (有机层)+3H+ (水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+水溶液,从平衡角度解释其原因:___________________________________。
CeT3 (有机层)+3H+ (水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+水溶液,从平衡角度解释其原因:___________________________________。
(7)已知,298K时,Ksp[Ce(OH)3]=5×l0-20,若溶液中c(Ce3+)=0.05mol·L-1,加碱调节pH到_________时Ce3+开始沉淀(忽略加碱过程中溶液体积变化)。
(8) 写出向Ce(OH)3悬浊液中通入氧气得到产品Ce(OH)4的化学方程式:___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色。
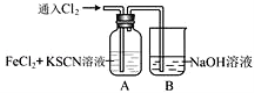
(1)A中铁元素发生反应的离子方程式有______________________________________________________。
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验:取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在______(填化学符号)。
(3)资料显示:SCN--的电子式为 ![]() 。甲同学猜想SCN― 可能被Cl2氧化了,他进行了如下研究:取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN― 中被氧化的元素是___________(填名称)。
。甲同学猜想SCN― 可能被Cl2氧化了,他进行了如下研究:取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN― 中被氧化的元素是___________(填名称)。
查看答案和解析>>
科目: 来源: 题型:
【题目】苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸。
Ⅰ.制备苯甲酸和回收未反应的甲苯
反应原理:

第1步:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应;
第2步:过滤反应混合物,得到滤液;经过操作Ⅰ,得到有机层和水层;
第3步:向有机层中加无水Na2SO4,过滤,经过操作Ⅱ,得到无色液体A;
第4步:向水层加入浓盐酸酸化,蒸发浓缩,冷却,过滤,得到白色固体B;
已知:
相对分子质量 | 熔点 | 沸点 | 密度 | 溶解度 | |
甲苯 | 92 | -95℃ | 110.8℃ | 0.8669g·mL-1 | 极微溶于水 |
苯甲酸 | 122 | 122.4℃ | 249℃ | 1.2659 g·mL-1 | 0.3g (25℃时) 6.9g (95℃时) |
(1)操作Ⅰ所用的玻璃仪器有烧杯和______________,操作Ⅱ为________________。
(2)第3步中加入无水Na2SO4的目的是_____________________,无色液体A是_______。
Ⅱ.提纯粗苯甲酸
(3)该同学利用重结晶的方法对得到的B进行提纯。重结晶的过程:__________→_________ →_______ →抽滤(与过滤类似)→洗涤→干燥→纯苯甲酸。(注:抽滤装置如图所示,主要仪器有A布氏漏斗,B抽滤瓶,抽气泵等)
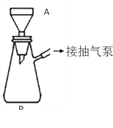
(4)白色固体B中的杂质是____________。
(5)趁热抽滤得到的滤液放置冷却可以结晶出纯净的苯甲酸晶体,为了得到更多的苯甲酸,是不是温度越低越好并说明理由______(填“是”或“不是”),理由___________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
(实验方案)将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01![]() 105Pa)的体积。
105Pa)的体积。
(问题讨论)
(1)同学们拟选用下列实验装置完成实验:

①最简易的装置需要上述三个仪器,它们的其连接顺序是:A接( )( )接( )____________
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶。猜测可能的原因是__________________________________________。
③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是___________ 。
A.待实验装置冷却后再读数
B.上下移动量筒F,使其中液面与广口瓶中液面相平
C.上下移动量筒G,使其中液面与广口瓶中液面相平
D.视线与凹液面的最低点水平,读取量筒中水的体积
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了如图所示的实验装置。
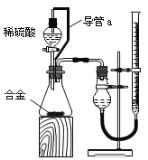
①装置中导管a的作用是_______________________________;打开分液漏斗活塞时稀硫酸能顺利滴下,滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差。
②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为________ mL。
查看答案和解析>>
科目: 来源: 题型:
【题目】《必修1》中学习过:A过滤、B蒸发(结晶)、C蒸馏、D分液、E萃取、F配制一定物质的量浓度的溶液,根据所学的知识回答下列下列问题:
(1)选用适当的方法分离或提纯,应选用上述哪一种?(填序号)
①除去 NaCl 溶液中所含的少量 KNO3__________;
②从碘水中提取碘__________;
③用自来水制取蒸馏水__________;
④分离植物油和水__________;
(2)除过滤、蒸发(结晶)外还有_____实验用到了玻璃棒。需要加热的实验有蒸发(结晶)和__________;填序号)。
(3)图是硫酸试剂瓶标签上的内容。实验室用该硫酸配制240mL0.46mol/L的稀硫酸,则

a.需量取该硫酸的体积为__________mL;
b.有以下仪器:①烧杯 ②100mL量筒 ③250mL容量瓶④500mL容量瓶 ⑤玻璃棒 ⑥托盘天平(带砝码)⑦10mL量筒⑧胶头滴管,配制过程中,必须使用的仪器是_____(填代号);
(4)该同学实际配制得到的浓度为0.47mol/L,可能的原因是_______________
A.量取浓H2SO4时仰视刻度 B.容量瓶洗净后未经干燥处理
C.没有将洗涤液转入容量瓶 D.定容时仰视刻度
查看答案和解析>>
科目: 来源: 题型:
【题目】某澄清溶液中含有下表离子中的一种或多种。分别取它的水溶液两份进行实验,结果如下:
阳离子 | Fe2+、Fe3+、Al3+ |
阴离子 | SO32-、CO32-、SiO32-、I-、NO3- |
①向一份溶液中加入过量盐酸,产生气泡,溶液颜色变深,但仍澄清;
②继续向①溶液中加入少许四氯化碳,震荡,静置,下层呈现紫红色,上层溶液呈现黄色;
③向另一份溶液中加入过量氢氧化钠溶液,产生沉淀的质量与加入碱液的体积关系如图所示。
根据以上信息,回答下列问题:

(1)原溶液中肯定含有的离子是______________________________________________;
(2)①中生成的气体是______________(填化学符号),它具有的性质是_____________(填字母序号);
A.无色无味 B.能被NaOH溶液吸收 C.属于大气污染物 D.难溶于水
(3)①中发生反应的离子方程式有_______________________________________________。
(4)③中沉淀溶解的化学反应方程式是________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在无土栽培中,配制1 L内含0.5 mol NH4Cl、0.16 mol KCl、0.24 mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需这三种固体的物质的量为______、______、________
(2)在反应X+2Y=R+2M中,已知R和M的摩尔质量之比为22∶9,当1.6gX与Y完全反应后,生成4.4gR,则此反应中Y和M的质量之比为_________。
(3)一种不纯的铁,已知它含有铜、铝、镁等一种或几种金属杂质,5.6g这样的铁跟足量的稀H2SO4作用,生成H2 2.24L(标准状况),则此铁块中一定含有的金属杂质是____ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用如下图所示装置来制备乙炔,并验证乙炔的某些化学性质,制备的 乙炔气体中往往含有少量的 H2S 和PH3气体,请按下列要求填空:
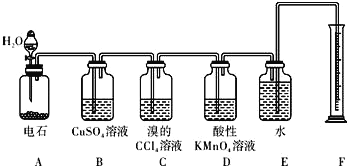
(1)实验室制乙炔的化学方程式是:_________________;为了得到较为平稳的乙炔气流, 装置 A 的分液漏斗中常用______________来代替水.
(2)装置 B 中CuSO4溶液的作用是_______________________________.
(3)装置 D 中观察到的现象是 ___________________________________________
(4)若称取m g 电石,反应完全后,生成的乙炔n g,则CaC2的纯度为_____(用m与n表示)。
(5)写出以乙炔和HCl为原料,合成聚氯乙烯的方程式是________________,___________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com