
科目: 来源: 题型:
【题目】如下图所示是由4个碳原子结合成的4种烃(氢原子没有画出)。
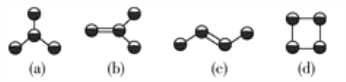
(1)写出有机物(b)的系统命名法的名称:________。
(2)上述有机物中,分子中碳原子一定在同一平面的是______________、______________(填结构简式)。
(3)上述有机物中不能与溴水发生反应使其褪色的有______(填字母代号)。
(4)等质量的上述四种物质完全燃烧耗氧量最大的是______(填结构简式)
查看答案和解析>>
科目: 来源: 题型:
【题目】硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC), 由于具有效率高、产物清洁无污染和燃料易于储存和运输等优点,被认为是一种很有发展潜力的燃料电池。其工作原理如下图所示,下列说法正确的是
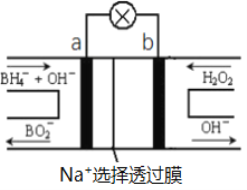
A. 电池的负极反应为BH4-+2H2O-8e-=BO2-+8H+
B. 放电时,每转移1mol电子,理论上有1molNa+透过选择透过膜
C. 电池放电时Na+从b极区移向a极区
D. 电极a发生还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列热化学方程式及有关应用的叙述中,正确的是
A. 甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+ 2O2(g) ═ CO2(g) + 2H2O(g) △H = -890.3kJmol-1
B. 已知强酸与强碱在稀溶液里反应的中和热为57.3kJmol-1,则![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)═
Ba(OH)2(aq)═![]() BaSO4(s)+H2O(l) △H < -57.3kJmol-1
BaSO4(s)+H2O(l) △H < -57.3kJmol-1
C. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g)![]() 2NH3(g) △H = -38.6kJmol-1
2NH3(g) △H = -38.6kJmol-1
D. 已知25℃、101KPa条件下:4Al(s) + 3O2(g) ═ 2A12O3(s) △H = -2834.9kJmol-1,4Al(s) + 2O3(g) ═ 2A12O3(s) △H = -3119.1kJmol-1,则O3比O2稳定
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,无水硫酸铜粉末为受热分解生成CuO和气体A。气体A为SO2、SO3和O2中的一种或几种。请回答:
(1)只用一种试剂就能证明气体A中是否含有SO2,该试剂可以是__________;
a. 石蕊溶液 b. 品红溶液 c. 氯化钡溶液 d. 酸性高锰酸钾溶液
(2)对气体A的合理组成进行如下假设:
①只有SO3一种气体;②只有两种气体;③三种气体都有
若假设②成立,写出无水硫酸铜受热分解的反应方程式___________;
(3)若气体A中SO2、SO3和O2都有,用如图所示装置定量测定经NaOH溶液吸收后剩余气体体积(气体体积最后换算为标准状况)。
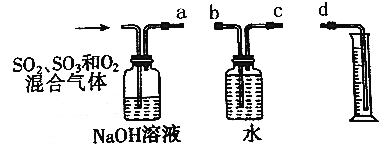
①装置的连接顺序为____________;(用字母表示);
②实验中测定的是_________气体的体积;
③实验发现测定结果比理论值明显偏低,其原因是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】海水中有丰富的资源,多种多样的海洋动物、植物、矿藏等。如图是从海水中提取某些物质的示意图。已知:海水中含量最高的几种离子的浓度依次为
微粒种类 | Cl- | Na+ | Mg2+ |
| Ca2+ |
微粒浓度 | 0.55mol·L-1 | 0.47mol·L-1 | 0.054mol·L-1 | 0.027mol·L-1 | 0.01mol·L-1 |
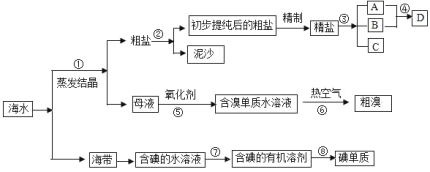
请根据以上信息回答下列问题:
(1)写出步骤②的操作名称_______;实验室中步骤⑤所需的玻璃仪器除烧杯外,还需要的仪器是___________。
(2)D具有杀菌消毒的作用,请写出反应④的离子方程式___________。
(3)初步提纯后的粗盐中含有等Ca2+、Mg2+、![]() 等杂质,精制得到精盐的步骤顺序为________。(用字母序号填空)
等杂质,精制得到精盐的步骤顺序为________。(用字母序号填空)
a.加适量盐酸;b.加稍过量的氯化钡溶液,再加稍过量的NaOH溶液;c.过滤;d.蒸发结晶;e.加稍过量碳酸钠溶液
(4)____________(填“能”或“不能”)用![]() 一种试剂替代步骤②中两种试剂,理由是________。
一种试剂替代步骤②中两种试剂,理由是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有常见金属单质A、B和气体甲、乙及C、D、E、F之间发生如下反应(图中有些反应所需的反应条件和部分产物没有全部标出)。
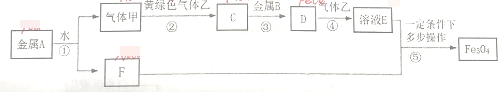
按要求回答下列问题:
(1)金属A元素在周期表中的位置为____;黄绿色气体乙的分子式为____;
(2)在①~⑤的反应中属于置换反应的有___;
(3)写出反应①的离子方程式____;
(4)写出反应④的离子方程式___;
(5)若33.6g的金属B完全反应,则在第④步反应中需消耗标准状况下__L的气体乙。
查看答案和解析>>
科目: 来源: 题型:
【题目】维拉佐酮是临床上使用广泛的抗抑郁药,其关键中间体G的合成路线如下:
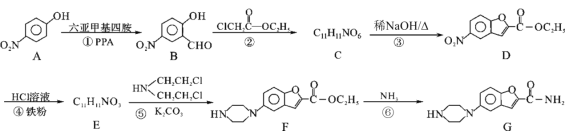
已知:![]()
请回答下列问题:
(1)A中含氧官能团的名称______________。
(2)反应④的反应类型是:______________。
(3)下列有关说法错误的是______________。
a.B遇FeCl3溶液显紫色且能发生银镜反应
b.A、B两种物质不可用核磁共振氢谱或红外光谱区别
c.C能发生取代、加成、氧化、还原反应
d.E能与NaOH反应,不能与盐酸反应
(4)写出E与NH(CH2CH2Cl)2反应得到F的化学方程式:____________________;⑤中加入K2CO3的作用是______________________________________________。
(5)B的同分异构体中,满足下列条件的有_____种;
①含有苯环;②能与NaOH溶液反应
写出其中一种核磁共振氢谱为三组峰的结构简式:________________________。
(6)已知: RBr ![]() RCN
RCN ![]() RCOOH,请以甲苯、乙醇等为原料制备
RCOOH,请以甲苯、乙醇等为原料制备![]() ,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见题干)______________
,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见题干)______________
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期律与周期表是学习元素化合物知识的重要工具。C与Si,N与P分别位于同一主族。其气态氢化物的分解温度如下表:
物质 | CH4 | SiH4 | NH3 | PH3 |
分解温度/K | 873 | 773 | 1073 | T |
(1)CH4分解温度高于SiH4的原因是_________。
(2)仅依据元素非金属性强弱关系,预测PH3分解温度(T)的范围________;
(3)某同学为证明非金属性![]() ,设计如图装置:
,设计如图装置:
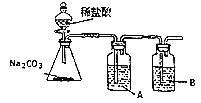
①A处盛放的试剂是__________;
②B中出现的现象是______;B处发生的离子反应方程式为_____________;
③该同学的设计中存在的问题是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求回答下列问题:
(1)氯气的制取方法有很多,写出实验室用MnO2来制取氯气的离子方程式__________。
(2)工业炼铁通常在___________设备中进行,需要用到铁矿石、焦炭、__________和空气。
(3)氯化铁溶液通常应用于印刷电路板制作,写出其反应的离子方程式___________。
(4)请写出红热的炭与浓硫酸反应的化学方程式__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸(H2C2O4)是一种重要的有机化工原料。为探究草酸的制取和草酸的性质,进行如下实验。
实验Ⅰ:探究草酸的制备
实验室用硝酸氧化淀粉水解液法制备草酸:C6H12O6+12HNO3 → 3H2C2O4+9NO2↑+3NO↑+9H2O。装置如下图所示:
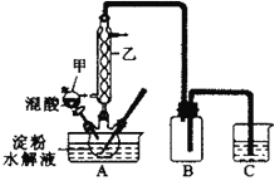
(1)上图实验装置中仪器乙的名称为:___________,B装置的作用____________。
(2)检验淀粉是否完全水解所需要的试剂为:__________。
实验Ⅱ:探究草酸的不稳定性
已知:草酸晶体(H2C2O4·2H2O)无色,易溶于水,熔点为101℃,受热易脱水、升华,170℃以上分解产生H2O、CO和CO2。草酸的酸性比碳酸强,其钙盐难溶于水。
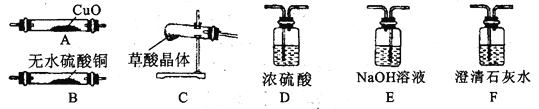
(3)请选取以上的装置证明草酸晶体分解的产物(可重复使用,加热装置和连接装置已略去)。仪器装置连接顺序为:C→______→______→______→______→D→A→F______
(4)若实验结束后测得A管质量减轻4.8g,则至少需分解草酸晶体的质量为_____g(已知草酸晶体的M=126g/mol)。
实验Ⅲ:探究草酸与酸性高锰酸钾的反应
(5)取一定量草酸溶液装入试管,加入一定体积的酸性高锰酸钾溶液,振荡试管,发现溶液开始缓慢褪色,后来迅速变成无色。(反应热效应不明显,可忽略不计)
该实验中草酸表现______性,该反应的离子方程式_____________________________________________,该反应的反应速率先慢后快的主要原因可能是___________________。
(6)设计实验证明草酸是弱酸。实验方案:________________________________ (提供的药品及仪器:蒸馏水、0.1mol·L-1NaOH溶液、pH计、0.1mol·L-1草酸溶液,其它仪器自选)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com