
科目: 来源: 题型:
【题目】CH4是一种清洁、高效、具有优良的环保性能的燃料,其燃烧热为890.3KJ·mol-1。它可以作为燃料电池的燃料。
(1)写出甲烷燃烧的热化学方程式:________;
(2)已知H2(g)和C(S)的燃烧热分别是285.8kJ·mol-1、393.5kJ·mol-1;则反应C(S)+ 2H2(g)=CH4(g)的反应热⊿H=______________;
(3)以甲烷、空气、氢氧化钾溶液为原料,惰性电极为电极可以构成燃料电池。该电池的负极反应式为:___________________;
(4)用(3)中的燃料电池为电源,以石墨为电极电解500mL滴有酚酞的NaCl溶液,装置如图所示:
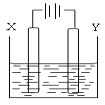
①请写出电解过程中阴极附近观察到的现象:___________________。
②到燃料电池消耗2.8LO2(标准状况下)时,计算此时NaCl溶液的pH=____(假设溶液的体积不变,气体全部从溶液中逸出)。
在Y极通过的电子的物质的量为:______________。
③电解之后,要使溶液恢复原状,应该向溶液中加入物质_____(填名称),溶液中Cl―流向___极(填“X”或“Y”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】单晶硅是制作电子集成电路的基础材料,对硅的纯度要求很高。制得高纯度硅的化学方程式为:①SiO2 + 2C ![]() Si + 2CO ②Si + 3HCl
Si + 2CO ②Si + 3HCl![]() SiHCl3 + H2 ③SiHCl3 + H2
SiHCl3 + H2 ③SiHCl3 + H2 ![]() Si + 3HCl,则有关反应分类说法正确的是
Si + 3HCl,则有关反应分类说法正确的是
A.①②③均属于氧化还原反应B.只有①属于置换反应
C.只有①属于氧化还原反应D.③属于复分解反应
查看答案和解析>>
科目: 来源: 题型:
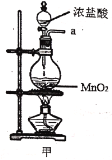
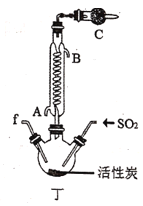
【题目】实验室用干燥而纯净的氯气和二氧化硫合成硫酰氯(SO2Cl2),原理为SO2+Cl2![]() SO2Cl2,装置如图所示(夹持仪器已省略):
SO2Cl2,装置如图所示(夹持仪器已省略):
已知有关物质的部分性质如表:
物质 | 熔点/℃ | 沸点/℃ | 其他性质 |
SO2Cl2 | -54.1 | 69.1 | ①易与水反应,产生大量白雾 ②易分解:SO2Cl2 |
H2SO4 | 10.4 | 338 | 不易分解 |
请回答下列问题:
(1)写出甲中制取Cl2的化学方程式___。
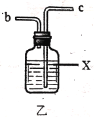
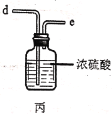
(2)利用图中甲、乙、丙装置制取干燥纯净的Cl2,并在丁装置合成硫酰氯,要完成实验目的,按气流从左到右,各接口正确的连接顺序是___。
A.abcdef B.abcedf C.acbdef D.acbedf
乙中试剂X是___。
(3)丁中冷凝管进水口为___(填“A”或“B”)。装置C的作用是___。
(4)硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸。从分解产物中分离出硫酰氯的方法是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室以孔雀石[主要成分是CuCO3·Cu(OH)2,还含有少量杂质FeO、Fe2O3、SiO2]为原料制备CuSO4·5H2O步骤如下:
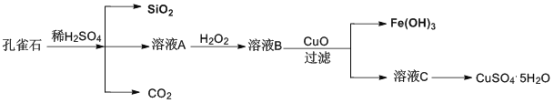
请回答下列问题:
(1)溶液A的金属离子有Fe3+和___。检验溶液A中含有Fe3的试剂是___。
(2)溶液A中加入H2O2的目的是___,发生的离子方程式为___。
(3)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、___、过滤等操作。
(4)溶液B与CuO反应生成Fe(OH)3和溶液C的化学方程式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 molXY2含有54 mol电子。
(1)该融雪剂的化学式是___;Y与氢元素形成的化合物的电子式是___。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是___;D与E能形成一种非极性分子,该分子的结构式为___;D所在族元素的氢化物中,沸点最低的是(填化学式)___。
(3)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,该反应的离子方程式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求回答下列问题:
(1)硫酸工业生产中,反应产生SO2气体的设备名称___。
(2)以下物质中:①H2SO4,②CaCl2,③NaHS,④He,⑤镁。
化学键只含共价键的是___;只含离子键的是___。
(3)用双桥表示3Cl2+6KOH=5KCl+KClO3+3H2O电子转移的方和数目:___。
(4)在一定条件下,利用置换反应X+Y=W+Z,可实现物质之间的转化
①若X为Mg,W为C,则Z为(填化学式)___。
②若X为SiO2,工业上利用焦炭还原二氧化硅的化学方程式___。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据研究有机化合物的步骤和方法,填满下列空格:
实验步骤 | 解释或实验结论 |
(1)测得A的蒸气密度是同状况下甲烷的4.375倍,试通过计算填空: | (1)A的相对分子质量为_______。 |
(2)将此A 5.6g在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重7.2g和17.6g | (2)A的实验式是________________。 (3)A的分子式为 _______________。 |
(3)将A通入溴水中,溴水褪色 | (4)说明A属于______________类(若溴水不褪色,则A属于 __________类) |
(4)A的核磁共振氢谱如图: | (5)综上所述,A的结构简式为 ______________。 |
查看答案和解析>>
科目: 来源: 题型:
【题目】由硫铁矿烧渣(主要成分:Fe3O4、Fe2O3和FeO)得到绿矾(FeSO4·7H2O),再通过绿矾制备铁黄[FeO(OH)]的流程如下:
![]()
已知:FeS2和铁黄均难溶于水。下列说法不正确是
A.步骤①,硫酸酸溶后溶液中主要有Fe3+、Fe2+等阳离子
B.步骤②的反应FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+,消耗1molFeS2转移16mol电子
C.步骤③,得到的绿矾晶体久置于空气中会变质
D.步骤④,反应条件控制不当会使铁黄中混有Fe(OH)3
查看答案和解析>>
科目: 来源: 题型:
【题目】下表所列各组物质中,物质之间通过一步反应能实现如图所示转化关系的是
X | Y | Z | 物质转化关系 | |
A | Cu | CuO | Cu(OH)2 |
|
B | S | SO3 | H2SO4 | |
C | NaHCO3 | Na2CO3 | NaOH | |
D | FeCl2 | FeO | FeCl3 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸工业中SO2转化为SO3是重要的反应之一,在一定压强和催化剂作用下在2L密闭容器中充入0.8molSO2和2molO2发生反应:2SO2(g)+O2(g)![]() 2SO3(g),SO2的转化率随温度的变化如下表所示:
2SO3(g),SO2的转化率随温度的变化如下表所示:
温度 | 450 | 500 | 550 | 600 |
SO2的转化率% | 97.5 | 95.8 | 90.50 | 80.0 |
(1)由表中数据判断△H________0(填“>”、“=”或“<”)。
(2)能判断该反应是否达到平衡状态的是___________。
A.容器的压强不变 B.混合气体的密度不变
C.混合气体中SO3的浓度不变 D. C(SO2)=C(SO3)
E.V正(SO2)=V正(SO3) F. V正(SO3)=2V逆(O2)
(3)某温度下经2min反应达到平衡后C(SO2)=0.08mol·L-1。
①0-2min之间,O2的反应速率为____。
②此时的温度为____℃。
③此温度下的平衡常数为_____(可用分数表示)。
(4)若将平衡反应混合物的压强增大(假如体积可变),平衡将_________向移动。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com