
科目: 来源: 题型:
【题目】下表中评价合理的是
选项 | 化学反应及其离子方程式 | 评 价 |
A | NaHSO4溶液与Ba(OH)2溶液反应至 SO42-沉淀完全: 2H++SO42-+Ba2++2OH- = BaSO4↓ + 2H2O | 正 确 |
B | 向碳酸镁溶液中加入足量稀盐酸: CO32-+2H+=CO2↑+H2O | 错误,碳酸镁不应写成离子形式 |
C | 向沸水中滴加饱和的氯化铁溶液至液体变为红褐色: Fe3++3H2O = Fe(OH)3↓+3H+ | 正 确 |
D | NaOH溶液中通入少量CO2反应:OH-+CO2=HCO3- | 正 确 |
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 氧化还原反应一定属于四大基本反应类型
B. 氧化还原反应中,反应物不是氧化剂就是还原剂
C. 在氧化还原反应中,氧化剂和还原剂既可以是不同物质也可以是同种物质
D. 失电子越多,还原性越强,得电子越多,氧化性越强
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、X均为中学化学常见物质,一定条件下它们有如图所示转化关系(部分产物已略去)。下列说法正确的是( )
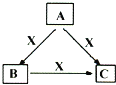
A. 若X为KOH溶液,则A可能为Al
B. 若X为Fe,则C可能为Fe(NO3)2溶液
C. 若A、B、C均为焰色反应呈黄色的化合物,则X一定为CO2
D. 若X为O2,则A可为有机物乙醇,也可为非金属单质硫
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组利用如图所示装置制备少量NCl3。已知:NCl3可由Cl2与NH4Cl溶液在适宜温度下反应生成。常温下,NCl3为黄色油状液体,熔点为-40℃,沸点为71℃;极易爆炸,自然爆炸点为95℃。
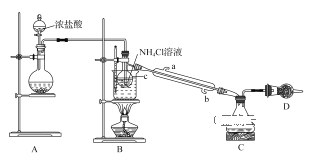
回答下列问题:
(1)装置A中圆底烧瓶内所盛放的固体是___(填化学式)。
(2)装置B中仪器C的名称是___,实验过程中该仪器内发生反应的化学方程式为___。
(3)装置B的烧杯中应控制水浴加热的温度范围为____。
(4)装置D中所盛放的试剂不能为下列选项中的___(填字母)。
a.生石灰 b.NaOH固体 C.碱石灰 d.无水CaCl2
(5)查阅资料可知,电解pH<5的NH4Cl溶液也可制得NCl3,则电解池中产生NCl3的电极为___(填“阴极’’或“阳极’’),该电极的电极反应式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】将1 mol乙醇(其中的氧用18O标记)在浓硫酸存在条件下与足量乙酸充分反应。下列叙述错误的是( )
A. 生成的乙酸乙酯中含有18O
B. 生成的水分子中不含有18O
C. 可能生成88 g乙酸乙酯
D. 可能生成90 g乙酸乙酯
查看答案和解析>>
科目: 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生下列反应:
2N2O5(g)![]() 4NO2(g)+ O2(g) △H >0 T1温度下的部分实验数据为:
4NO2(g)+ O2(g) △H >0 T1温度下的部分实验数据为:
t/s | 0 | 500 | 1000 | 1500 |
c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是
A. 500s内N2O5分解速率为2.96×10—3mol/(L· s)
B. T1温度下的平衡常数为K1=125(mol/L)3,1000s时转化率为50%
C. T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若T1>T3,则K1> K3
D. 其他条件不变时,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2
查看答案和解析>>
科目: 来源: 题型:
【题目】KNO3固体样品中含有少量的KCl、BaCl2杂质,为了提纯KNO3并分离得到BaCl2,进行如下实验操作:
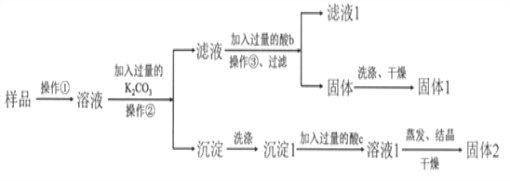
(1)试剂c的化学式是__________,固体1的化学式是__________。加入过量K2CO3所发生反应的化学方程式为________________________________。
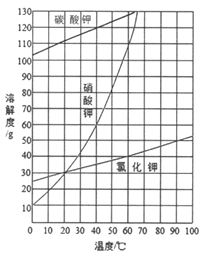
(2)结合下图各物质的溶解度曲线可知操作③的名称是_______、________。
(3)有同学认为操作③之前无需加入过量的酸b,也能得到纯净的固体1,你认为该同学的观点是否正确?_____;并做出相应解释___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】向两份30ml同一浓度的NaOH溶液中通入CO2气体,因CO2通入量的不同,溶液的组成也不同,得到溶液M、N。若向M、N溶液中逐滴加入浓度为0.25mol·L-1盐酸,产生的气体体积v(CO2)与加入盐酸的体积v(HCl)的关系分别为如图所示两种情况A和B。
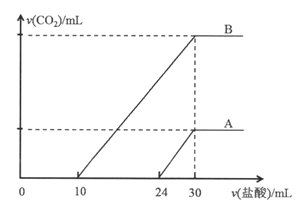
请回答下列问题:
(1)NaOH溶液的物质的量浓度为_____________。
(2)M、N两溶液中相同组分溶质的物质的量之比为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某铁矿石(若只含铁的氧化物和SiO2)取36g溶于过量的稀盐酸中,过滤、洗涤、干燥后得5.6g不溶物,向得到的滤液中加入足量的NaOH溶液,过滤、洗涤后将沉淀灼烧,得32g红棕色固体.根据题意下列结论不正确的是( )
A. 由铁矿石转化为红棕色固体的过程中发生了氧化还原反应
B. 溶于盐酸后得到的滤液中n(Fe2+):n(Fe3+)=1:1
C. 铁矿石中的铁的氧化物的化学式一定是Fe3O4
D. 若稀盐酸为3.0molL﹣1 400mL,反应前后体积变化忽略不计,则滤液中剩余H+的物质的量浓度是0.5molL﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com