
科目: 来源: 题型:
【题目】化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究:查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体产生。
Ⅰ.摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水充足搅拌、过滤。
(1)往滤渣中加入过量 NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是_________________。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸,观察到的现象是__________________,通入过量二氧化碳的离子方程式是_________________。
Ⅱ.牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
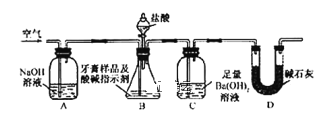
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:_____。
(4)C中反应生成沉淀的离子方程式是________。
(5)下列各项措施中,不能提高测定准确度的是___(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取8.0g样品三份,进行三次测定,测得BaCO3平均质量为3.94 g。则样品中碳酸钙的质量分数为__________。
(7)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据物质结构有关性质和特点,回答下列问题:
(1)Ti基态原子核外电子排布式为 _____基态铝原子核外电子云形状有_________(填名称)。
(2)丙烯腈(CH2=CH-CN)分子中α键和![]() 键的个数比为_____,分子中碳原子轨道的杂化类型是___
键的个数比为_____,分子中碳原子轨道的杂化类型是___
(3)写出与NH4+互为等电子体的一种分子和一种离子的化学式______、_______。
(4)钛存在两种同素异构体,![]() 采纳六方最密堆积,
采纳六方最密堆积,![]() 采纳体心立方堆积,鉴别两种钛晶体可以用_____法,由
采纳体心立方堆积,鉴别两种钛晶体可以用_____法,由![]() 转变为
转变为![]() 晶体体积_____(填“膨胀”或“收缩”)。
晶体体积_____(填“膨胀”或“收缩”)。
(5)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用____________形象化描述。
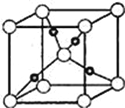
(6)Cu与O元素形成的某种化合物的晶胞结构如图所示,晶胞中氧原子的配位数为____,若阿伏伽德罗常数为NA,晶胞的边长为a pm,该晶体的密度为__gcm﹣3.
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,从A处通入新制备的Cl2,关闭B阀时,C处的红色布条看不到明显现象;当打开B阀后,C处红色布条逐渐褪色。D瓶中装的是( )

①浓硫酸 ②NaOH溶液 ③H2O ④饱和NaCl溶液
A. ①③ B. ②④ C. ①② D. ③④
查看答案和解析>>
科目: 来源: 题型:
【题目】将0.15mol的MnO2与过量的12mol/L的浓盐酸反应,与50ml 12mol/L的浓盐酸与过量MnO2反应,两者产生的氯气相比(其它反应条件相同)
A.一样多 B.前者较后者多 C.后者较前者多 D.无法比较
查看答案和解析>>
科目: 来源: 题型:
【题目】龙癸醛是一种珍贵香料,广泛应用于香料、医药、染料及农药等行业。其合成路线如图所示(部分反应产物和反应条件已略去)。

回答下列问题:
(1)下列有关R和烯烃C3H6的说法正确的是__________________。(填代号)
A.它们的实验式相同 B.它们都能使溴水褪色
C.它们都能发生加成反应 D.它们都含有碳碳双键
(2)反应⑤的试剂和条件是___________________________;反应③的类型是_____________________。
(3)T所含官能团的名称是________;反应④的化学方程式为__________________________________。
(4)X的名称是____________________。
(5)遇氯化铁溶液发生显色反应的T的同分异构体有________种,其中,在核磁共振氢谱上有4组峰且峰面积比为1∶2∶3∶6的结构简式为_______________________________________________。
(6)参照上述流程图,以2—甲基—1,3—丁二烯为原料,经三步制备2—甲基—1,4—丁二醛,设计合成路线:________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。根据下列反应回答问题:
A.![]()
B.![]()
C.![]()
D.![]()
(1)上述反应中,H2O2仅体现氧化性的反应是(填序号,下同)_________,H2O2仅体现还原性的反应是(填序号,下同)_________,H2O2既体现氧化性又体现还原性的反应是________。
(2)上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序是________
(3)某酸性反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:![]() 。已知该反应中H2O2只发生了如下过程:H2O2→O2。
。已知该反应中H2O2只发生了如下过程:H2O2→O2。
①写出上述反应的离子方程式并配平_______________________________________
②如果上述反应中有6.72L(标准状况)气体生成,转移的电子为_______mol。
(4)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),发生以下反应:![]() ,试指出生成物A的化学式为________。
,试指出生成物A的化学式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有五瓶损坏标签的试剂,分别盛有AgNO3溶液、稀硝酸、盐酸、氯化钡溶液、碳酸钾溶液,为了确定各瓶中是什么试剂,将它们任意编号为A、B、C、D、E,用小试管各盛少量多次进行两两混合反应,反应现象为:A与B、A与E均可产生白色沉淀,其中A与B反应所产生沉淀不溶于酸,A与E反应所生成的白色沉淀可以溶于C或D;B与D、B与E产生沉淀;E与C、E与D反应均可产生二氧化碳气体;而C与D由于属于同一类物质,混合时无反应现象。
由此,可判定各试剂瓶中所盛试剂为(用化学式表示)
A________;B________;C________;D________;E________。
另外,请写出下面要求的离子方程式:
(1)A与E:
________________________________________________________。
(2)A与B:
_________________________________________________________。
(3)C与E:
__________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外研究性学习小组拟用粗盐(含有少量杂质包括:泥沙、CaCl2、MgCl2、Na2SO4)经提纯后,配制0.4mol/L 450mL NaCl溶液.他们设计并实施了如下实验,请根据已学过的知识回答下列问题:
(1)取一定量的粗盐置于烧杯中加适量的水溶解。将配制的粗盐悬浊液过滤后取滤液加入过量的除杂试剂,如果除杂试剂可从下列六种溶液中选择①Na2CO3溶液②KOH溶液③AgNO3溶液④NaOH溶液⑤NaHCO3溶液⑥BaCl2溶液,则正确的试剂和加入的顺序应为:__________(填选项)
A.①②③ B.②⑥⑤ C.④⑥① D.①④⑥ E.⑥①④ F.⑥②⑤
(2)将所得的悬浊液经过滤后取滤液加入足量的盐酸,充分反应后对混合溶液进行蒸发、过滤、洗涤、干燥操作,得到纯净的NaCl固体,请描述在蒸发操作过程中玻璃棒的作用:_______________________________________________________
(3)利用(2)中所得的NaCl固体继续配制所需溶液.在托盘天平上称量____g NaCl固体.配制过程中需要使用的玻璃仪器有:烧杯、玻璃棒、_________
和_______________
(4)配制结束后同学们对实验中出现的某些错误操作,对最终配制的溶液浓度的影响进行了分析,则下列错误操作会导致最终配制溶液中NaCl的浓度相比0.4mol/L是偏小的是__________
A.在上述(2)步中没有使用盐酸处理滤液;
B.在上述(3)步中没有对烧杯和玻璃棒进行洗涤;
C.定容时俯视凹液面;
D.上下颠倒摇匀后液面低于刻度线,未及时加水至刻度线。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有四组分散系:①汽油和水形成的乳浊液 ②含有泥沙的食盐水 ③溶有碘(I2)的碘化钾溶液 ④乙二醇和丙三醇混合溶液(乙二醇和丙三醇的部分物理性质见下表)。
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
乙二醇 | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
请用下图所示的仪器分离以上各混合液,仪器和方法不能对应的是 ( )
(1)![]() (2)
(2)![]() (3)
(3)![]() (4)
(4)![]()
A.①-(3)-分液B.②-(2)-过滤
C.③-(2)-萃取D.④-(1)-蒸馏
查看答案和解析>>
科目: 来源: 题型:
【题目】在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N—N键的键能为160kJ·mol-1(N2的键能为942kJ·mol-1),晶体片段结构如右图所示。又发现利用N2可制取出N5、N3。含N5+离子的化合物及N60、N5极不稳定。则下列说法错误的是( )
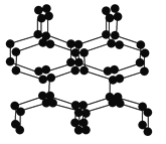
A. 按键型分类,该晶体中含有非极性共价键
B. 含N5+离子的化合物中既有离子键又有共价键
C. 高聚氮与N2、N3、N5、N5+、N60互为同素异形体
D. 这种固体的可能潜在应用是烈性炸药或高能材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com