
科目: 来源: 题型:
【题目】以氯酸钠等为原料制备亚氯酸钠的工艺流程如下,下列说法错误的是

A. NaClO3在发生器中作氧化剂
B. 吸收塔中1mol H2O2得到2mol电子
C. 吸收塔中温度不宜过高,会导致H2O2的分解
D. 从“母液”中可回收的主要物质是Na2SO4
查看答案和解析>>
科目: 来源: 题型:
【题目】W、X、Y、Z四种元素的原子序数依次增大。其中Y原子的L电子层中,成对电子与未成对电子占据的轨道数相等,且无空轨道;X原子的L电子层中未成对电子数与Y相同,但还有空轨道;W、Z 的原子序数相差10,且Z原子的第一电离能在同周期中最低。
(1)写出下列元素的元素符号:W____,X____,Y____,Z____。
(2)XY分子中,X原子与Y原子都达到8电子稳定结构,则XY分子中X和Y原子用于成键的电子数目分别是____;根据电子云重叠方式的不同,分子里共价键的主要类型有____。
(3)XY2与ZYW反应时,通过控制反应物的物质的量之比,可以得到不同的产物,相同条件下,在水中溶解度较小的产物是________(写化学式)。
(4)写出Z2Y2的电子式:____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)有两种活性反应中间体离子,它们的离子中均含有1个碳原子和3个氢原子。请依据下面给出的这两种微粒的球棍模型,写出相应的化学式:
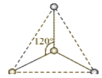 ___________;
___________;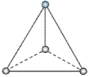 ______________。
______________。
(2)按要求写出第二周期非金属元素构成的中性分子的化学式。
平面三角形分子___________,三角锥形分子____________,正四面体形分子_____________。
(3)写出SO3的常见的等电子体的化学式:一价阴离子____________ (写出一种,下同),二价阴离子____________,它们的中心原子采用的杂化方式都是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知X、Y和Z 三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为__________,该元素的符号是__________。X与同周期卤族元素的第一电离能比较,较大的是____________________(填元素符号)。
(2)Y元素原子的价层电子的电子排布图为________,该元素的名称是__________。
(3)X与Z可形成化合物XZ3,XZ3分子的VSEPR模型为____________________。
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是___________________。
(5)XY43-的空间构型为__________,与其互为等电子体的一种分子__________。
(6)X的某氧化物的分子结构如图所示。

该化合物的化学式为___________,X原子采取___________杂化。
查看答案和解析>>
科目: 来源: 题型:
【题目】向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性。金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A. Cu与Cu2O的物质的量之比为2∶1 B. 硝酸的物质的量浓度为2.6mol/L
C. 产生的NO在标准状况下的体积为4.48L D. Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D, E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
A | 原子核外有6种不同运动状态的电子 |
C | 基态原子中s电子总数与p电子总数相等 |
D | 原子半径在同周期元素中最大 |
E | 基态原子最外层电子排布式为3s23p1 |
F | 基态原子的最外层p轨道有两个电子的自旋方向与其他电子的自旋方向相反 |
G | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
H | 是我国使用最早的合金中的最主要元素 |
请用化学用语填空:
(1)A元素位于元素周期表第_______周期_______族;B元素和C元素的第一电离能比较,较大的是________,C元素和F元素的电负性比较,较小的是________。
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的分子模型为________,B元素所形成的单质分子![]() 键与π键数目之比为________。
键与π键数目之比为________。
(3)G元素的低价阳离子的离子结构示意图是________,F元素原子的价电子的轨道表示式是________,H元素的基态原子核外电子排布式的________。
(4)G的高价阳离子的溶液与H单质反应的离子方程式为_________________;与E元素成对角线关系的某元素的最高价氧化物的水化物具有两性,写出该两性物质与D元素的最高价氧化物的水化物反应的离子方程式:_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D是中学化学常见的单质,甲、乙、丙为化合物,乙在常温常压下为无色无味的液体,元素A有可变化合价。它们之间存在如下图的所示的转化关系。由此推断:

(1)甲的化学式为_____________,丙的化学式为______________。
(2)写出甲和D反应的化学方程式___________________________________________。
(3)为检验化合物甲中元素的化合价,需要用到的药品有_________________________。
A.稀硫酸 B.盐酸 C.硫氰化钾溶液 D.高锰酸钾溶液
(4)为测定A和乙高温反应后所得固体中化合物甲的质量分数。取反应后所得固体并设计以下实验:
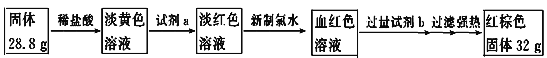
化合物甲的质量分数为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是金属钨晶体中的一个晶胞的结构示意图,它是一种体心立方结构。实验测得金属钨的密度为19.30 g·cm-3,钨的相对原子质量是183.9。假设金属钨原子为等径刚性球,试完成下列问题:

(1)每一个晶胞中均摊到________个钨原子。
(2)计算晶胞的边长a________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知氯化铝的熔点为190℃(2.02×105Pa),但它在180℃即开始升华。
(1)氯化铝是________________(填“离子化合物”或“共价化合物”)。
(2)在500K和1.01×105Pa时,它的蒸气密度(换算成标准状况时)为11.92g·L-1,且已知它的结构中有配位键(当共价键中共用的电子对是由其中一原子独自供应,另一原子提供空轨道时,就形成配位键)。配位键形成后,就与一般共价键无异,氯化铝的化学式为________,结构式为________。
(3)无水氯化铝在空气中强烈地“发烟”,其原因是______________________。
(4)设计一个更可靠的实验,判别氯化铝是离子化合物还是共价化合物。你设计的实验是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com