
科目: 来源: 题型:
【题目】以干海带为原料提取碘单质和氯化钾的过程主要分三步:完成下列填空:
(1)步骤一:灼烧干海带,使其灰化后用热水浸泡、过滤,制得原料液,含有氯化钾等物质。实验室灼烧海带应放在____(填写仪器名称)中加热,选用热水而不是冷水浸泡海带灰的目的是____。
(2)步骤二:原料液经结晶过滤分离出氯化钾后,向滤液中通适量氯气氧化I-,制得富碘溶液。实验室模拟氧化过程的实验装置如图所示。
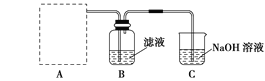
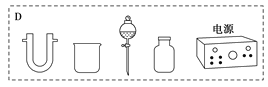
装置中A部分用于制取氯气,实验室制取氯气通常有两种方案:一是在强酸性条件下用氧化剂氧化Cl-;二是电解法。限用图D中的仪器(支撑仪器、导管、导线、石墨棒和橡皮塞除外),能实现的反应是___(选填编号)。
a.2NaCl(s)+MnO2+2H2SO4(浓)![]() MnSO4+Cl2↑+Na2SO4+2H2O
MnSO4+Cl2↑+Na2SO4+2H2O
b.2KMnO4+16HCl(浓)→2MnCl2+2KCl+5Cl2↑+8H2O
c.2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
d.4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
广口瓶B中发生反应的离子方程式是____。装置C中NaOH的作用是___。
(3)步骤三:取100 mL B中富碘溶液,按如下流程分离碘单质。
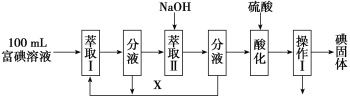
萃取Ⅱ和酸化过程发生的离子反应方程式分别是:
3I2+6OH-=5I-+IO3-+3H2O;____;
萃取剂X应选择____(选填编号)。
a.100mL苯 b.10mL乙醇 c.10 mLCCl4 d.10mL己烯
实验室进行萃取操作的仪器是_____。操作Ⅰ的名称是___。
(4)分离出的KCl样品中常含有少量NaCl和K2CO3等物质,设计实验用沉淀法测定氯化钾样品中K2CO3的质量分数:①要用到的化学试剂是___(填写化学式);②要测定的物理量是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物的结构简式如图所示,Na、NaOH、NaHCO3分别与等物质的量的该物质恰好反应时,Na、NaOH、NaHCO3的物质的量之比为( )
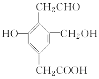
A. 3∶3∶2B. 3∶2∶1
C. 1∶1∶1D. 3∶2∶2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n
B. 一种烃在足量的氧气中燃烧并通过浓硫酸,减少的总体积就是生成的水蒸气的体积
C. 某气态烃CxHy与足量O2恰好完全反应,如果反应前后气体体积不变(温度>100℃),则y=4;若体积减小,则y>4;否则y<4
D. 相同质量的烃,完全燃烧,消耗O2越多,烃中含H量越高
查看答案和解析>>
科目: 来源: 题型:
【题目】下列卤代烃在KOH醇溶液中加热不反应的是( )
①![]() ②
②![]() ③ (CH3)3CCH2Cl ④ CHCl2CHBr2 ⑤
③ (CH3)3CCH2Cl ④ CHCl2CHBr2 ⑤ ![]() ⑥ CH3Cl
⑥ CH3Cl
A. ①③⑥B. ②③⑤C. 全部D. ②④
查看答案和解析>>
科目: 来源: 题型:
【题目】为了纪念元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。回答下列问题:
(1)Ag与Cu在同一族,则Ag在周期表中_____(填“s”、“p”、“d”或“ds”)区。[Ag(NH3)2]+中Ag+空的5s轨道和5p轨道以sp杂化成键,则该配离子的空间构型是_____。
(2)表中是Fe和Cu的部分电离能数据:请解释I2(Cu)大于I2(Fe)的主要原因:______。
元素 | Fe | Cu |
第一电离能I1/kJ·mol-1 | 759 | 746 |
第二电离能I2/kJ·mol-1 | 1561 | 1958 |
(3)亚铁氰化钾是食盐中常用的抗结剂,其化学式为K4[Fe(CN)6]。
①CN-的电子式是______;1mol该配离子中含σ键数目为______。
②该配合物中存在的作用力类型有______(填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力
(4)MnO的熔点(1660℃)比MnS的熔点(1610℃)高,其主要原因是________。
(5)第三代太阳能电池利用有机金属卤化物碘化铅甲胺(CH3NH3PbI3)半导体作为吸光材料,CH3NH3PbI3具有钙钛矿(AMX3)的立方结构,其晶胞如图所示。

①AMX3晶胞中与金属阳离子(M)距离最近的卤素阴离子(X)形成正八面体结构,则M处于_______位置,X处于______位置(限选“体心”、“顶点”、“面心”或“棱心”进行填空)。
③CH3NH3PbI3晶体的晶胞参数为a nm,其晶体密度为dg·cm-3,则阿伏加德罗常数的值NA的计算表达式为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A.在标况下1mol N2的体积为22.4L/mol
B.分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA
C.1L一氧化碳气体一定比1L氧气的质量小
D.常温常压下,8g O3中含有8NA个电子
查看答案和解析>>
科目: 来源: 题型:
【题目】青蒿素是一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命。它的分子式为C15H22O5,关于青蒿素的说法正确的是( )
A.2.82g青蒿素含氧原子数目为0.05NA
B.标准状况下,1 mol青蒿素的体积为22.4 L
C.青蒿素含氧的质量分数为10%
D.青蒿素的摩尔质量为282
查看答案和解析>>
科目: 来源: 题型:
【题目】环戊烯是生产精细化工产品的重要中间体,其制备涉及的反应如下:
氢化反应: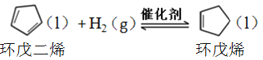 ,
,![]()
副反应: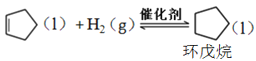 ,
,![]()
解聚反应: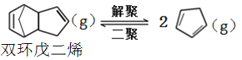 ,
,![]()
回答下列问题:
(1)反应![]() 的△H= _____ kJ/mol。
的△H= _____ kJ/mol。
(2)一定条件下,将环戊二烯溶于有机溶剂进行氢化反应(不考虑二聚反应),反应过程中保持氢气压力不变,测得环戊烯和环戊烷的产率(以环戊二烯为原料计)随时间变化如图所示:
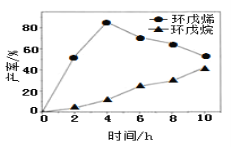
①0~4h氢化反应速率比副反应快的可能原因是_________。
②最佳的反应时间为__h。若需迅速减慢甚至停止反应,可采取的措施有____(写一条即可)。
③一段时间后,环戊烯产率快速下降的原因可能是_________。
(3)解聚反应在刚性容器中进行(不考虑氢化反应和副反应)。
①其他条件不变,有利于提高双环戊二烯平衡转化率的是 ____(填标号)。
A.增大双环戊二烯的用量 B.使用催化剂 C.及时分离产物 D.适当提高温度
②实际生产中常通入水蒸气以降低双环戊二烯的温度(水蒸气不参与反应)。某温度下,通入总压为300 kPa的双环戊二烯和水蒸气,达到平衡后总压为500 kPa,双环戊二烯的转化率为80%,则p(H2O)=______kPa,平衡常数Kp=_______kPa (Kp为以分压表示的平衡常数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气,所需实验装置如图所示

(1)写出装置中发生反应的程式________
(2)连接上述仪器,仪器的正确连接顺序是 a→________
(3)NaOH 溶液的作用是(用化学方程式表示)________
(4)将干燥的 Cl2 依次通过干燥的有色布条和湿润的有色布条,可观察到的现象是________,得出的结论是________
(5)实验结束后,取少量 E 装置中的溶液于烧杯中,加入足量浓盐酸后会产生一种黄绿色气体,写出生成该气体的离子方程式________
查看答案和解析>>
科目: 来源: 题型:
【题目】七叶树内酯的结构如下图,若1mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )
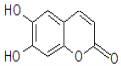
A. 2molBr2、2molNaOHB. 2molBr2、3molNaOH
C. 3molBr2、4molNaOHD. 4molBr2、4molNaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com