
科目: 来源: 题型:
【题目】36.5 g HCl溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,NA表示阿伏加德罗常数,则下列叙述中正确的是( )
A. 所得溶液的物质的量浓度为1 mol·L-1
B. 所得溶液中含有NA个HCl分子
C. 36.5 g HCl气体占有的体积为22.4 L
D. 所得溶液的质量分数:w=![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,CuS、MnS在水中的沉淀溶解平衡曲线如图所示,下列说法错误的是

A. a点对应的Ksp大于b点对应的Ksp
B. 向CuSO4溶液中加入MnS发生如下反应:Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq)
C. 在含有CuS和MnS固体的溶液中c(Cu2+):c(Mn2+)=2×10﹣23:1
D. 该温度下,Ksp(CuS)小于Ksp(MnS)
查看答案和解析>>
科目: 来源: 题型:
【题目】向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式____________________。
(2)下列三种情况下,离子方程式与(1)相同的是_____(填序号)。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度![]() 表示)可近似地用图中的_____曲线表示(填序号)。
表示)可近似地用图中的_____曲线表示(填序号)。
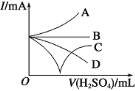
(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图所示,向该烧杯里缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应。在此实验过程中,小球将_____(选填“上浮”、“不动”、“下降”)。
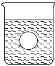
查看答案和解析>>
科目: 来源: 题型:
【题目】某烃A的相对分子质量为84.回答下列问题:
(1)若烃A为链烃,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种。
① A的结构简式为___________________________名称为____________________________
② 链烃A与Br2的CCl4溶液反应生成B,写出由A生成B的化学方程式:______________
③ 与A互为同分异构体,且主链碳原子个数与A相同的链烃有_____种(不包括A)
(2)若A不能使溴水褪色,且分子中只有一种化学环境的氢原子,则A的结构简式为_______________
查看答案和解析>>
科目: 来源: 题型:
【题目】托盘天平、容量瓶、量筒是常见的中学化学计量仪器,熟知这些仪器的使用是定量研究化学的基础。
(1)其中标示出使用温度的仪器是________________。
(2)下列操作中,容量瓶所不具备的功能有________________ (填序号)。
A.配制一定体积准确浓度的标准溶液 B.贮存溶液
C.测量容量瓶规格以下的任意体积的溶液 D.准确稀释某一浓度的溶液
E.量取一定体积的液体 F.用来加热溶解固体溶质
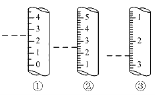
(3)如图是某些仪器的刻度部分示意图,图中各仪器虚线为所示读数。其中为量筒的是________________ (填编号,),读数为_____mL。
(4)实验室用98%的浓硫酸配制(浓硫酸的密1.84g/mL)450mL 0.1 mol·L-1的硫酸。回答下列问题
① 配制中应选用的玻璃仪器有_________________,应量取________mL 98%的浓硫酸。
② 量筒在使用前已洗干净但不干燥,对结果是否造成影响________(填“是”或“否”),某同学认为将量筒内的浓硫酸倒出之后,应将量筒洗涤—下并将洗涤液倒入烧杯中,最后转移到容量瓶中,你认为他的做法______(填“对”或“错”)。
③对浓硫酸稀释过程中遇到下列情况,使所配制的硫酸浓度大于 0.1mol/L有 ______(填序号)
A.未经冷却趁热将溶液注入容量瓶中
B.摇匀后发现液面低于刻度线,再加水至刻度线
C.容量瓶中原有少量蒸馏水
D.定容时俯视观察液面
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯。
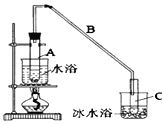
已知:
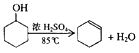
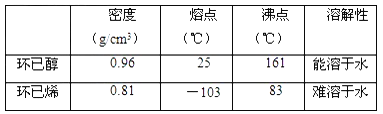
(1)制备粗品:
将12.5 mL环己醇加入试管A中,再加入l mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①导管B除了导气外还具有的作用是_____________________________________。
②试管C置于冰水浴中的目的是_____________________________________。
(2)制备精品:
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_____层(填上或下),分液后用________(填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②将分液得到的环己烯再进行蒸馏,收集产品时,控制的温度应在_______左右。
(3)以下区分环己烯精品和粗品的方法,合理的是___________。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某链烃A的相对分子质量为42,能发生下列转化关系(部分反应物或生成物及反应条件已略去),其中D可发生银镜反应,F是一种有香味的物质。
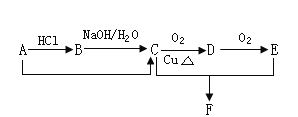
请回答下列问题:
(1)写出下列物质的结构简式:A____________,F____________;
(2)写出下列反应B→C的化学方程式:____________,其反应类型为_______________;
(3)写出D发生银镜反应的化学方程式:_______________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】已知溶液中存在平衡:Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) ΔH<0,下列有关该平衡体系的说法正确的是
Ca2+(aq)+2OH-(aq) ΔH<0,下列有关该平衡体系的说法正确的是
①升高温度,平衡逆向移动
②向溶液中加入少量碳酸钠粉末能增大钙离子的浓度
③除去氯化钠溶液中混有的少量钙离子,可以向溶液中加入适量的NaOH溶液
④恒温下,向溶液中加入CaO,溶液的pH升高
⑤给溶液加热,溶液的pH升高
⑥向溶液中加入Na2CO3溶液,其中固体质量增加
⑦向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
A. ①⑥B. ①⑥⑦C. ②③④⑥D. ①②⑥⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室需纯净的NaCl晶体,但现有的NaCl晶体中混有少量的Na2SO4和NH4HCO3,为除去杂质,甲同学设计了如下实验:(已知NH4HCO3 ![]() NH3↑+H2O+CO2↑)
NH3↑+H2O+CO2↑)
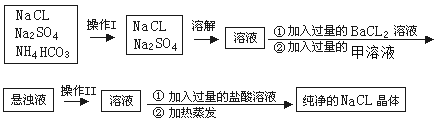
(1)上述操作I、II的名称分别为______、_______
(2)进行操作“加入过量的BaCl2溶液”时,如何判断BaCl2溶液已过量,其方法是______________________________________________________
(3)操作“加入过量的甲溶液”,甲溶液为______溶液,此操作的目的是________________________。
(4)操作“加入过量的盐酸溶液”的目的是________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用规范的化学用语回答下列问题
(1)下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

①从氯化钾溶液中得到氯化钾固体,选择装置__________ (填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置_________,为检测Cl-杂质是否除干净,应进行的操作_________________________________
②从碘水中分离出I2的方法,名称为________________________。
③装置A中①的名称是________,进水的方向是从______(填“上”“下”)口进水,装置B在分液时为使液体顺利下滴,应进行的具体操作是_______________________。
(2)实验室配制Fe(OH)3胶体时,将饱和的FeCl3溶液滴入沸水中,并继续加热至溶液呈红褐色,停止加热。向所得胶体中逐滴加入稀硫酸,开始观察到的现象是__________,这种现象称为胶体的________;最后观察到的现象是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com