
科目: 来源: 题型:
【题目】下列离子方程式中,正确的是( )
A. 小苏打溶液与少量澄清石灰水混合:Ca2++OH-+HCO3-===CaCO3↓+H2O
B. AlCl3溶液中加入足量的氨水:Al3++4OH-===AlO2-+2H2O
C. 将氯气通入水中:Cl2+H2O===Cl-+ClO-+2H+
D. 向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-===3Fe3++NO↑+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】浓硫酸广泛应用在稀有金属的湿法冶金、漂染工业、金属加工、无机药品及有机药物的生产等领域中。
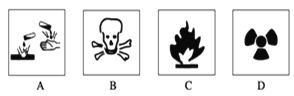
Ⅰ.(1)在盛放浓硫酸的试剂瓶的标签上应印有图警示标志中的____________。
(2)用12.0mol/L浓硫酸配制230mL 0.3mol/L的稀硫酸,需要用量筒量取浓硫酸的体积为______。
(3)溶液配制过程中需要的玻璃仪器除了烧杯、玻璃棒、量筒,还有____________________。
(4)溶液稀释过程中有以下操作:
a.量取浓硫酸和一定体积的水,在烧杯中稀释;
b.计算所需浓硫酸的体积;
c.上下颠倒摇匀;
d.加蒸馏水至刻度线1-2cm地方,改用胶头滴管加蒸馏水至凹液面与刻度线相切;
e.将稀释液转移入容量瓶,洗涤烧杯和玻璃棒,并将洗涤液转移入容量瓶,振荡;
以上正确的操作顺序为__________________________
(5)实验过程中的以下操作会导致最终所配溶液浓度(填“偏大”、“偏小”或“不变”)
a.量取浓硫酸时俯视:__________ 。
b.量取浓硫酸后,清洗了量筒并将洗涤液转移入容量瓶:__________ 。
c.实验前,容量瓶中有少量残留蒸馏水:__________
查看答案和解析>>
科目: 来源: 题型:
【题目】利用“化学计量在实验中的应用”的相关知识填空。
(1)含有6.02×1023个氧原子的H2SO4的物质的量是___________。
(2)与标准状况下V LCO2所含氧原子数目相同的水的质量是___________g(用分式表示)
(3)设NA为阿伏加德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是________(用含NA的式子表示)。
(4)将4 g NaOH溶解在水中配成10 mL溶液,再稀释成1 L,从中取出10 mL,这10 mL溶液的物质的量浓度为_______。
(5)体积比为1∶2∶3的氯化钠、氯化镁和氯化铝溶液,分别加入等体积、等浓度的硝酸银溶液,均恰好完全反应生成氯化银沉淀,则这三种溶液的物质的量浓度之比为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】T℃时,在一固定容积的密闭容器中发生反应:A(g)+B(g)![]() C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是
C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是

A. T℃时,该反应的平衡常数值为4
B. c点没有达到平衡,此时反应向逆向进行
C. 若c点为平衡点,则此时容器内的温度高于T℃
D. T℃时,直线cd上的点均为平衡状态
查看答案和解析>>
科目: 来源: 题型:
【题目】把aL含硫酸铵和硝酸铵的混合液分成2等份,一份需用bmol烧碱刚好把铵全部反应,另一份与氯化钡溶液反应时,消耗cmol氯化钡。由此可知原溶液中NO3-离子的物质的量浓度为(单位:mol·L-1)
A.![]() mol/LB.
mol/LB.![]() mol/L
mol/L
C.![]() mol/LD.
mol/LD.![]() mol/L
mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】NA为阿伏加德罗常数的数值,下列说法中正确的是( )
①0.5molO3与11.2LO2所含的分子数一定相等
②标准状况下,22.4L氯气与足量铝充分反应,转移的电子数为3NA
③通常状况下,NA 个CO2分子占有的体积为22.4L
④常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
⑤常温下,4.4g CO2和N2O(不反应)混合物中所含有的原子数为0.3 NA
⑥在反应KIO3+6HI===KI+3I2+3H2O中,每生成3molI2转移的电子数为6NA
⑦标准状况下,22.4 L SO3含有的分子数为NA
⑧在常温常压下,1 mol O2含有的原子数为2NA.
⑨物质的量浓度为0.5 mol·L-1 MgCl2溶液中,含有Cl-个数为NA
⑩将100 mL 0.1 mol·L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒数目为0.01NA
A. ①②④⑧B. ④⑤⑧C. ③⑥⑨⑩D. ④⑤⑧⑨
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g) ![]() CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )
CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )

A. 该反应的ΔH>0
B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C. 在T2时,若反应体系处于状态D,则此时一定有v正<v逆
D. 在T3时,若混合气体的密度不再变化,则可以判断反应达到平衡状态C
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中不正确的是
A. 14g由N2和13C2H2组成的混合物中,所含中子数为7NA
B. CH4与白磷(P4)都为正四面体结构,则1mol CH4与lmolP4所含共价键的数目均为4NA
C. 反应N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ/mol,若放出热量4.62kJ,则转移电子的数目为0.3NA
2NH3(g) ΔH=-92.4kJ/mol,若放出热量4.62kJ,则转移电子的数目为0.3NA
D. 常温下,含0.5molNH4NO3与xmolNH3·H2O的中性溶液中,含有NH4+的数目为0.5NA
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中的一定量的混合气体发生反应:xA(g)+yB(g)![]() zC(g)平衡时测得C的浓度为1 mol·L-1,保持温度不变,将容器的容积扩大到原来的2倍,再达到平衡时,测得C的浓度为0.6 mol·L-1,下列有关判断正确的是( )
zC(g)平衡时测得C的浓度为1 mol·L-1,保持温度不变,将容器的容积扩大到原来的2倍,再达到平衡时,测得C的浓度为0.6 mol·L-1,下列有关判断正确的是( )
A. x+y>zB. 平衡向逆反应方向移动
C. B的转化率降低D. A的体积分数减小
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:A(g)+2B(g) ![]() 2C(g) ΔH=-Q kJ·mol-1(Q>0),在恒容的密闭容器中充入1 mol A和2 mol B,一定条件下发生反应。下列有关说法正确的是( )
2C(g) ΔH=-Q kJ·mol-1(Q>0),在恒容的密闭容器中充入1 mol A和2 mol B,一定条件下发生反应。下列有关说法正确的是( )
A. 平衡前,随着反应的进行,容器内气体密度逐渐减小
B. 平衡时,该反应放出的热量为Q kJ
C. 平衡后,再向容器中通入1 mol氦气,A的转化率增大
D. 平衡后,缩小容器容积,A的浓度增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com