
科目: 来源: 题型:
【题目】由环己烷可制得1,2—环己二醇,反应过程如下:

下列说法错误的是
A. ①的反应条件是光照 B. ②的反应类型是消去反应
C. ③的反应类型是取代反应 D. ④的反应条件是NaOH、H2O加热
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物A是农药生产中的一种中间体,其结构简式如图,下列叙述不正确的是( )

A. 有机物A属于芳香族化合物
B. 有机物A和NaOH的醇溶液共热可发生消去反应
C. 有机物A和浓硫酸混合加热,可以发生消去反应
D. 1molA和足量的NaOH溶液反应,最多可以消耗 3molNaOH
查看答案和解析>>
科目: 来源: 题型:
【题目】化学镀铜废液中含有一定量的CuSO4,任意排放会污染环境,利用电化学原理可对废液进行回收处理,装置如图,其中质子交换膜只允许H+通过。已知:①Cu2++ HCHO + 3OH-=Cu + HCOO-+ 2H2O;②还原性:HCHO > M(—种金属)> Cu。
下列说法正确的是
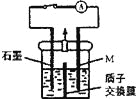
A. 反应之前,应将含OH-的HCHO溶液加入到装置的左侧
B. 右侧发生的电极反应式:HCHO-2e-+H2O=HCOO-+3H+
C. 若将质子交换膜换成阴离子交换膜,放电过程中,大量的OH-将向左侧迁移
D. 放电一段时间后打开开关,移去质子交换膜,装置中可能会有红色固体、蓝色絮状物出现
查看答案和解析>>
科目: 来源: 题型:
【题目】铜元素在化合物中其化合价可以呈现![]() 、
、![]() 价。
价。![]() 和
和![]() 是常见的
是常见的![]() 价铜的化合物,
价铜的化合物,![]() 是较为常见的
是较为常见的![]() 价铜的化合物。
价铜的化合物。
(1)铜元素位于周期表的_______区。属于________族。
(2)请写出![]() 的电子排布式__________________,S的价层电子排布图______________
的电子排布式__________________,S的价层电子排布图______________
(3)向![]() 溶液中滴加氨水,可以得到深蓝色的溶液,再加入乙醇后析出深蓝色晶体,写出深蓝色晶体的化学式__________________。比较
溶液中滴加氨水,可以得到深蓝色的溶液,再加入乙醇后析出深蓝色晶体,写出深蓝色晶体的化学式__________________。比较![]() 和
和![]() 中
中![]() 中键角的大小:
中键角的大小:![]() ___________
___________![]() (填“
(填“![]() ” “
” “![]() ” 或“=”)。
” 或“=”)。
(4)![]() 中阴离子的空间构型为_______
中阴离子的空间构型为_______
(5)![]() 的晶胞结构如图所示,C1原子位于立方体的顶点和面心,Cu原子位于Cl原子构成的四面体体心。
的晶胞结构如图所示,C1原子位于立方体的顶点和面心,Cu原子位于Cl原子构成的四面体体心。
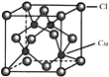
①每个Cl原子周围距Cl原子最近且等距离的Cu原子数目为________________。
②若以铜原子为顶点构成晶胞,面心原子为________(Cu、Cl)
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求回答问题
(1)用一种试剂除去下列物质中的杂质(括号内物质为杂质,所用试剂均为适量),写出所加的试剂及有关反应的离子方程式。
①FeSO4溶液(CuSO4):试剂___离子方程式___。
②Cu(Mg):试剂___,离子方程式___。
(2)写出下列反应的离子方程式
①氯化铁溶液与氢氧化钠溶液的反应___;
②常用澄清石灰水检验CO2气体___;
③用小苏打片(NaHCO3)治疗胃酸过多___。
(3)用双线桥标出下列反应中电子转移的方向和数目。___
Cl2+SO2+2H2O=H2SO4+2HCl
查看答案和解析>>
科目: 来源: 题型:
【题目】下列不能说明2NO2(g)![]() N2O4(g)已达到平衡状态的是( )
N2O4(g)已达到平衡状态的是( )
A. 温度和压强一定时,混合气体的密度不再变化
B. 温度和体积一定时,容器内压强不再变化
C. 条件一定,混合气体的平均相对分子质量不再变化
D. 反应速率2v(NO2)逆=v(N2O4)正
查看答案和解析>>
科目: 来源: 题型:
【题目】由P、S、Cl、Ni等元素组成的新型材料有着广泛的用途,回答下列问题。
(1)基态 Cl原子核外电子排布式为__________________________,P、S、Cl的第一电离能由大到小顺序为____________________,P、S、Cl的电负性由大到小顺序为_______________。
(2)SCl2分子中的中心原子杂化轨道类型是_____________,该分子构型为__________。
(3)Ni与CO能形成配合物Ni(CO)4,该分子中配位键个数为_______;以“—”表示σ键、“→”表示配位键,写出CO分子的结构式__________。
(4)已知MgO与NiO的晶体结构(如图1)相同, 其中Mg2+和Ni2+的离子半径分别为66 pm和69pm。则熔点:MgO_____NiO(填“>”、“<”或“=”),理由是_______________________________。

(5)若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为_______。
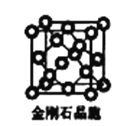
(6)金刚石晶胞含有____个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r= ______a,列式表示碳原子在晶胞中的空间占有率____(请用r和a表示不要求计算结果)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,非金属元素被还原的是( )
A. MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2OB. H2+CuO
MnCl2+Cl2↑+2H2OB. H2+CuO![]() Cu+H2O
Cu+H2O
C. 2FeCl2+Cl2===2FeCl3D. 2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)三氯化氮(NCl3)是一种黄色、油状、具有刺激性气味的挥发性有毒液体,其原子均满足8e—结构。写出其电子式_____________________。氯碱工业生产时,由于食盐水中通常含有少量NH4Cl,而在阴极区与生成的氯气反应产生少量三氯化氮,该反应的化学方程式为______________。
(2)已知:2CO2(g) + 3NaOH(aq)=NaHCO3(aq)+Na2CO3(aq)+H2O(l) △H=-4a kJ/mol
CO2(g) +2NaOH(aq)=Na2CO3(aq)+H2O(l) △H=-b kJ/mol
该条件下CO2与NaOH溶液反应生成NaHCO3的热化学反应方程式为:____________。
(3)利用CO可以将NO转化为无害的N2,其反应为:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),向容积均为IL的甲、乙、丙三个恒温(反应温度分别为300℃、T℃、300℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
N2(g)+2CO2(g),向容积均为IL的甲、乙、丙三个恒温(反应温度分别为300℃、T℃、300℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(CO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(CO)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
n(CO)(丙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40min内用NO的浓度变化表示的平均反应速率v(NO)=_______。
②该反应的△H______0(填“>”或“<”)。
③甲、丙容器达到平衡时,CO的转化率为α(甲)________α(乙)(填“>”,“< ”,“=”)
(4)常温下,在(NH4)2C2O4溶液中,反应NH4++C2O42—+H2O![]() NH3·H2O+HC2O4—的平衡常数K=___。(已知常温下,H2C2O4的电离平衡常数Ka1≈5×10-2,Ka2≈5×10-5 H2O的电离平衡常数Kw=1×10-14 NH3·H2O的电离平衡常数Kb≈2×10-5)
NH3·H2O+HC2O4—的平衡常数K=___。(已知常温下,H2C2O4的电离平衡常数Ka1≈5×10-2,Ka2≈5×10-5 H2O的电离平衡常数Kw=1×10-14 NH3·H2O的电离平衡常数Kb≈2×10-5)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com