
科目: 来源: 题型:
【题目】探究Na2O2与水的反应,实验如图:(已知:H2O2 ![]() H+ + HO2-、HO2-
H+ + HO2-、HO2- ![]() H+ + O22-)下列分析不正确的是
H+ + O22-)下列分析不正确的是
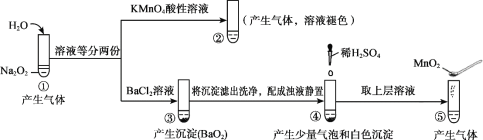
A. ①、⑤中产生的气体能使带火星的木条复燃
B. ①、④中均发生了氧化还原反应和复分解反应
C. ②、⑤中KMnO4与MnO2的作用不同,产生气体的量也不同
D. 通过③能比较酸性:HCl>H2O2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列中心原子的杂化轨道类型和分子几何构型不正确的是
A. PCl3中P原子sp3杂化,为三角锥形
B. BCl3中B原子sp2杂化,为平面三角形
C. CS2中C原子sp杂化,为直线形
D. H2S分子中,S为sp杂化,为直线形
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.某物质不是电解质就是非电解质
B.碳酸氢钠在水中的电离方程式:![]()
C.能电离出H+ 的化合物都是酸
D.导电性强的溶液里自由移动的离子数目不一定比导电性弱的溶液里自由移动的离子数多
查看答案和解析>>
科目: 来源: 题型:
【题目】一般较强酸可制取较弱酸,这是复分解反应的规律之一。已知在常温下测得浓度均为0.1mol/L的下列 3 种溶液的 pH:
溶质 | NaHCO3 | Na2CO3 | NaClO |
pH | 8.34 | 11.6 | 10.3 |
下列有关说法正确的是( )
A. 以上溶液的 pH 是用广泛 pH 试纸测定的
B. 反应CO2+H2O+2NaClO=Na2CO3+2HClO可以发生
C. 室温下,电离常数: K2( H2CO3)>K( HClO)
D. 在新制氯水中加入少量 NaHCO3固体可以提高溶液中 HClO 的浓度
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. NH3和CH4的中心原子都是sp3杂化
B. 基态原子的核外电子排布为[Kr]4d105s1的元素属于d区
C. SO2和CO2都是直线形分子,其中心原子都是sp杂化
D. 电子由低能级跃迁至较高能级时,可通过光谱仪直接摄取原子的发射光谱
查看答案和解析>>
科目: 来源: 题型:
【题目】氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成都需要用它。
(1)工业上通常采用电解法制氯气,请观察图后回答下列问题:

① 请写出该反应的化学方程式________________________________。
② 通电后,b侧产生的气体是______![]() 填化学式
填化学式![]() 。
。
(2)某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉![]() 这是一个放热反应
这是一个放热反应![]() ,回答下列问题:
,回答下列问题:

①在A装置中用固体二氧化锰与浓盐酸,在加热条件下制取氯气,请写出反应的化学方程式________________________________。
②漂白粉将在U形管中产生,其化学方程式是______________________________。
③装置C的作用是______________。
④此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应:
I.温度较高时氯气与消石灰反应生成![]() ,为避免此副反应的发生,可采取的措施是________________________。
,为避免此副反应的发生,可采取的措施是________________________。
II.试判断另一个副反应![]() 用化学方程式表示
用化学方程式表示![]() ______________________________,为避免此副反应的发生,可以在A与B之间连接一个装有______的洗气瓶。
______________________________,为避免此副反应的发生,可以在A与B之间连接一个装有______的洗气瓶。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是从元素周期表中截取的一部分,已知X、Y、Z、W为四种短周期主族元素,下列说法中不正确的是
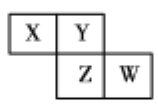
A. W的原子序数可能是X的原子序数的3倍
B. Z元素不可能为金属元素
C. 四种元素的原子有可能均能与氢原子形成18电子分子
D. W的气态氢化物的稳定性一定比Y的强
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是
A. AB3型的分子空间构型必为平面三角形
B. PCl3分子是三角锥形,这是因为磷原子是sp2杂化的结果
C. sp3杂化轨道是由任意的1个s轨道和3个p轨道混合形成的4个sp3杂化轨道
D. 中心原子采取sp3杂化的分子,其几何构型可能是四面体形或三角锥形或V形
查看答案和解析>>
科目: 来源: 题型:
【题目】以软锰矿(主要成分为MnO2,还含有少量的Fe2O3、FeO、Al2O3和SiO2)为原料制备马日夫盐[Mn(H2PO4)2·2H2O(磷酸二氢锰)]的主要工艺流程如图:
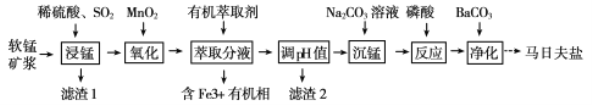
(1)用MnO2“氧化”时发生反应的离子方程式为__________________________________。
(2)如何检验“沉锰”己完成_____________________________________________________。
(3)铁离子的萃取率与接触时间和溶液的pH之间的关系如图1、2所示,则应选择的接触时间为_______;pH>1.7,铁离子的萃取率急剧下降的原因可能为____________________。
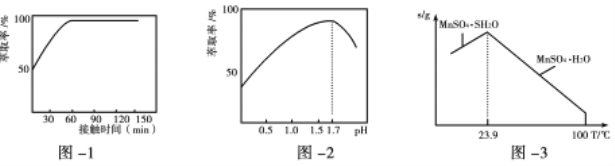
(4)结合图3的溶解度曲线,请补充完整由浸锰得到的溶液制备MnSO4·H2O的实验方案:边搅拌边向溶液中滴加适量的双氧水,再向滤液中加入MnCO3粉末调节溶液的pH范围为_________,过滤洗涤,将滤液与洗涤液合并,控制温度在80℃~90℃之间蒸发浓缩、______________,(填操作名称)得到MnSO4·H2O,用80℃~90℃的蒸馏水洗涤2~3次,放在真空干燥箱中低温干燥。[已知该溶液中pH=7.8时Mn(OH)2开始沉淀:pH=5.0时Fe(OH)3、Al(OH)3沉淀完全,pH=8.8时Fe(OH)2沉淀完全]。
查看答案和解析>>
科目: 来源: 题型:
【题目】含+6价铬的污水会污染环境,电镀厂产生的镀铜废水中往往含有一定量的![]() ,处理该废水常用还原沉淀法,具体流程如下:
,处理该废水常用还原沉淀法,具体流程如下:

(1)步骤①用稀硫酸调节pH,不选用盐酸的原因是______________________________。
(2)已知每消耗1mol Na2S2O3转移8mol e-,则加入Na2S2O3溶液时发生反应的离子方程式为:_________________________________________________________。
(3)已知Cr(OH)3的化学性质与Al(OH)3相似。步骤②加入NaOH溶液时要控制溶液的pH不能过高,是因为___________________________________________(用离子方程式表示)。
(4)下列溶液中可以代替上述流程中Na2S2O3溶液最佳的是__________(填选项序号);
A.FeSO4溶液 B.浓H2SO4C.Na2SO3溶液 D.酸性KMnO4溶液
(5)某厂废水中含1.50×10-3mol/L的![]() ,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Cr的化合价为+3,Fe的化合价依次为+3、+2)可变废为宝。欲使1 L该废水中的
,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Cr的化合价为+3,Fe的化合价依次为+3、+2)可变废为宝。欲使1 L该废水中的![]() 完全转化为Cr0.5Fe1.5FeO4,理论上需要加入__________gFeSO4·7H2O。(已知FeSO4·7H2O的摩尔质量为278g/mol)
完全转化为Cr0.5Fe1.5FeO4,理论上需要加入__________gFeSO4·7H2O。(已知FeSO4·7H2O的摩尔质量为278g/mol)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com