
科目: 来源: 题型:
【题目】肯定属于同族元素且性质相似的是( )
A. 原子核外电子排布式:A为1s22s2,B为1s2
B. 结构示意图:A为![]() ,B为
,B为![]()
C. A原子基态时2p轨道上有1个未成对电子,B原子基态时3p轨道上也有1个未成对电子
D. A原子基态时2p轨道上有一对成对电子,B原子基态时3p轨道上也有一对成对电子
查看答案和解析>>
科目: 来源: 题型:
【题目】关于Na2CO3和NaHCO3的说法正确的是 ( )
A.在水中的溶解性:NaHCO3>Na2CO3
B.与质量分数相同的盐酸溶液反应放出气体的快慢:NaHCO3<Na2CO3
C.热稳定性:NaHCO3<Na2CO3
D.等质量的固体与足量盐酸反应放出CO2的质量Na2CO3>NaHCO3
查看答案和解析>>
科目: 来源: 题型:
【题目】以炼锌烟尘(主要成分为ZnO,含少量CuO和FeO)为原料,制取氯化锌晶体的工艺流程如下:
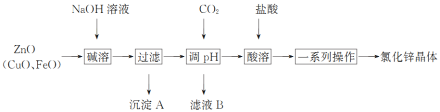
已知:Zn及其化合物的性质与Al及其化合物的性质相似,pH>11时,Zn(OH)2能溶于NaOH溶液生成ZnO22—。
(1)“调pH”步骤中通入过量CO2时发生反应的化学方程式为________;“酸溶”时发生反应的离子方程式为___________。
(2)下列说法不正确的是_______。
A 加入过量NaOH溶液的目的是提高锌元素的浸取率
B 沉淀A的主要成分是CuO、FeO
C 洗涤沉淀时,直接将洗涤剂加入漏斗,并用玻璃棒轻轻搅拌
D 利用结晶法可以从氯化锌溶液中获得氯化锌晶体
(3)流程中需进行蒸发浓缩,在实验室中进行蒸发浓缩的具体操作是_____。
(4)氯化锌晶体是白色晶体,可含1、1.5、2.5、3、4个结晶水,易潮解,易溶于水,溶于乙醇、丙酮。由氯化锌晶体制备无水氯化锌的装置如图,其中滴液漏斗中盛放的是SOCl2(SOCl2熔点为105 ℃、沸点为78.8 ℃、遇水剧烈水解生成两种酸性气体)。
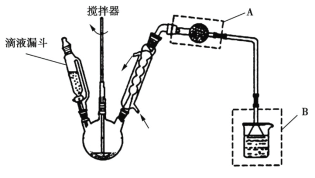
①下列物质中最适合洗涤氯化锌晶体的是_________。
A 冷水 B 浓盐酸 C 乙醇 D 氨水
②仪器A的名称为_______;装置B的作用是_________。
③以ZnCl2·H2O为例,写出三颈烧瓶中发生反应的化学方程式_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图像如图所示,下列说法正确的是
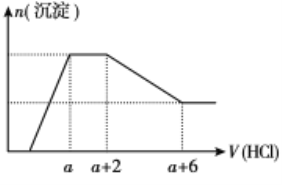
A. 原溶液中一定含有Na2SO4
B. 反应后最终溶液中的溶质只有AlCl3
C. 原溶液中含有CO32-与AlO2-的物质的量之比为1:1
D. 原溶液中一定含有的阴离子是OH-、SiO32-、AlO2-、CO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】这次中美贸易战的矛盾激化,也让我们看到了中国半导体产业存在的诸多不足,俗话说“亡羊补牢,为时未晚”,找出存在的不足,然后针对地去解决问题,才能让半导体产业链发展壮大起来。三氯化氧磷(POCl3)是一种重要的化工原料,常用作半导体掺杂剂及光导纤维原料。一研究小组在实验室模拟反应![]() 制备POCl3并测定产品含量。
制备POCl3并测定产品含量。
资料卡片:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -93.6 | 76.1 | 137.5 | 遇水剧烈水解,易与O2反应 |
POCl3 | 1.25 | 105.8 | 153.5 | 遇水剧烈水解,能溶于PCl3 |
SOCl2 | -105 | 78.8 | 119 | 遇水剧烈水解,受热易分解 |
(1)若选用Na2SO3固体与70%浓H2SO4制取SO2,反应的离子方程式是:______________。
(2)溶液A为饱和食盐水,乙装置中应该盛装的试剂为__________(填“P2O5”或“碱石灰”或“浓H2SO4”或“无水硫酸铜”);反应装置图的虚框中未画出的仪器最好选择______(填“己”或“庚”)。
(3)甲、丁装置的作用除了用于气体的净化除杂外,还有_____________________________。
(4)水浴加热三颈烧瓶,控制反应温度在60~65℃,其原因是_________________________。
(5)产品经提纯后仍含少量PCl3杂质,通过佛尔哈德法可测定产品中POCl3的含量:准确称取1.500g样品在碘量瓶中摇动至完全水解,将水解液配成100 mL溶液,取10.00 mL于锥形瓶中,加入0.2000 mol·L-1的AgNO3溶液20.00mL(Ag++C1-=AgC1↓),再加少许硝基苯,用力振荡,使沉淀被有机物覆盖。加入NH4Fe(SO4)2作指示剂,用0.1000mol·L-1KSCN标准溶液滴定过量的AgNO3至终点(Ag++SCN-=AgSCN↓),做平行实验,平均消耗KSCN标准溶液10.00mL。
①达到滴定终点的现象是_____________________________________________________。
②POCl3的质量分数为________________________。
③已知:KSP(AgC1)=3.2×10-10 mol2·L-2,KSP(AgSCN)=2×10-12 mol2·L-2,若无硝基苯覆盖沉淀表面,测定POCl3的质量分数将___________(填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】雾霾天气严重影响人们的生活,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一,以下方法可以消除氮氧化物和硫氧化物的污染。
(1)用活性炭还原法可处理氮氧化物,向某密闭容器中加入一定量的活性炭和NO,发生反应:![]() △H<0,在一定条件下,反应进行到不同时间测得各物质的浓度如下表。
△H<0,在一定条件下,反应进行到不同时间测得各物质的浓度如下表。
时间/min 浓度/mol·L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.52 | 0.40 | 0.40 | 0.44 | 0.44 |
N2 | 0 | 0.24 | 0.30 | 0.30 | 0.28 | 0.28 |
CO2 | 0 | 0.24 | 0.30 | 0.30 | 0.28 | 0.28 |
①0~10min内,NO的平均反应速率v(NO)=_______________。
②在恒容条件下,能判断该反应一定达到化学平衡状态的标志是_________(填字母编号)。
a.v正(N2)=2v逆(NO) b.反应体系的压强不再发生改变
c.![]() 不变 d.混合气体的密度保持不变
不变 d.混合气体的密度保持不变
③30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是___________。
(2)NH3催化还原氮氧化物技术是目前应用最广泛的烟气氮氧化物脱除技术。已知c(NO2):c(NO)=1:1时脱氮效果最佳,若生成1mol N2时反应放出的热量为Q kJ。此时对应的脱氮反应的热化学方程式为_____________________________________________________。
(3)利用钠碱循环法可脱除烟气中的SO2。
①在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是_____________________。
②吸收液吸收SO2的过程中,pH随n(![]() ):n(
):n(![]() )变化关系如下表:
)变化关系如下表:
n( | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
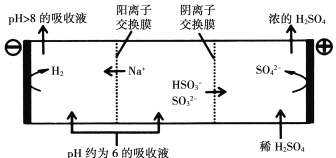
写出![]() 在阳极放电的电极反应式:_______________________________________,当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。
在阳极放电的电极反应式:_______________________________________,当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。
(4)利用喷雾干燥法脱硫工艺是除去SO2的常见方法,先将含SO2的废气溶于水,再用饱和石灰浆吸收。该温度下吸收液中c(Ca2+)一直保持为0.50 mol·L-1,已知KSP(CaSO3)=1.4×10-7,求吸收后溶液中![]() 的浓度______________________。
的浓度______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲溶液可能含有K+、Ca2+、NH4+、Cu2+、NO3-、Cl-、SO42-、CO32-八种离子中的若干种![]() 为确定甲溶液的组成,将其分成两等份,进行如下实验:
为确定甲溶液的组成,将其分成两等份,进行如下实验:
①向一份溶液中加入足量的NaOH浓溶液并加热,产生的气体在标准状况下体积为4.48L。
②向另一份溶液中加入0.6 mol/L的BaCl2溶液500mL,恰好可以与溶液中的离子完全反应,过滤得66.3g沉淀及滤液。
③向上述沉淀中加入过量的盐酸,产生的气体通入足量澄清的石灰水中,得到一定量的沉淀X。
④向上述滤液中加入1 mol/L AgNO3溶液650 mL,恰好可完全反应,据此,请回答下列问题![]() 用相应的离子符号表示
用相应的离子符号表示![]() :
:
⑴上述实验③中得到沉淀X的质量为______;生成沉淀X的离子方程式为______.
⑵甲溶液中一定不存在的离子是______;可能存在的离子是______.
⑶甲溶液一定存在的离子中,物质的量最大的离子是______;物质的量最小的离子是______,此物质的量最小的离子其物质的量为______。
查看答案和解析>>
科目: 来源: 题型:
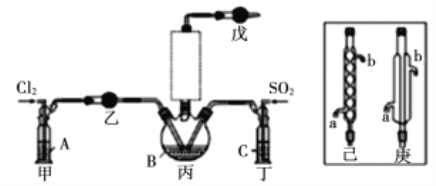
【题目】实验室利用印刷电路的废腐蚀液(含有大量CuCl2、FeCl2和FeCl3)回收Cu,主要流程如下:
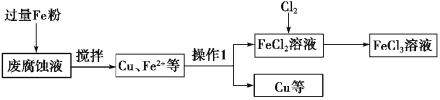
(1)操作1的名称是__________,需要用到的玻璃仪器有________________________。
(2)加入过量铁粉发生的离子反应有_______________。
(3)获得的铜粉中含有杂质,除杂所需的试剂是_______________(填化学式)。
(4)实验室利用如图所示装置制取一定量的FeCl3。
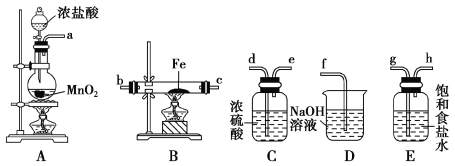
各装置的正确连接顺序为(填写装置代号)A→______→______→______→D。装置C的作用是____________________________,写出装置D中反应的离子方程式:_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77 kJmol-1
CH3OH(g) △H3=-90.77 kJmol-1
回答下列问题:
(1)反应Ⅱ的△H2=_________,若反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为K1、K2、K3,则K2=________(用K1、K3表示)。
(2)反应Ⅲ自发进行条件是___________(填“较低温度”、“较高温度”或“任何温度”)。
(3)在一定条件下2 L恒容密闭容器中充入3 mol H2和1.5 mol CO2,仅发生反应Ⅰ,实验测得不同反应温度与体系中CO2的平衡转化率的关系,如下表所示。
温度(℃) | 500 | T |
CO2的平衡转化率 | 60℅ | 40℅ |
①T______500℃(填“>”、“<” 、“=”)。
②温度为500℃时,该反应10 min时达到平衡。用H2表示该反应的反应速率v(H2)=______________;该温度下,反应I的平衡常数K=______________L2/mol2
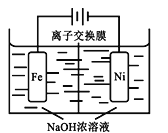
(4)由CO2制备甲醇还需要氢气。工业上用电解法制取Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图所示。电解一段时间后,c(OH)降低的区域在__________ (填“阴极室”或“阳极室”)。该室发生的电极反应式为:___________________________。
FeO42+3H2↑,工作原理如图所示。电解一段时间后,c(OH)降低的区域在__________ (填“阴极室”或“阳极室”)。该室发生的电极反应式为:___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D、E、F六种物质,它们的相互转化关系如下图(反应条件略,有些反应的产物和反应的条件没有全部标出)。已知A、B、E是单质,其中A着火只能用干燥的沙土灭火,B在常温下为气体,C俗名称为烧碱,D为无色无味液体。

(1)写出A、B、F的化学式 A______ B ______ F ______。
(2)写出A和D反应生成B和C的化学方程式_____________。若生成3mol的B,则转移的电子数目为_______________ 。
(3)写出E与C、D反应生成的B和F离子方程式____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com