
科目: 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)===CO2(g); C(s)+![]() O2(g)===CO(g)
O2(g)===CO(g)
②S(s)+O2(g)===SO2(g); S(g)+O2(g)===SO2(g)
③H2(g)+![]() O2(g)===H2O(l); 2H2(g)+O2(g)===2H2O(l)
O2(g)===H2O(l); 2H2(g)+O2(g)===2H2O(l)
④2KOH(aq)+H2SO4(aq)===K2SO4(aq)+2H2O(l);2KOH(aq)+H2SO4(浓)===K2SO4(aq)+2H2O(l)
⑤NaOH(aq)+HCl (aq)===NaCl (aq)+H2O(l); NaOH(aq)+HF(aq)===NaF(aq)+H2O(l)
A. ①③⑤B. ②④⑤C. ②③④D. ①②③
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应的ΔH等于反应物的总键能与生成物的总键能之差。
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),该反应的反应热ΔH为( )
Si(s)+4HCl(g),该反应的反应热ΔH为( )
A. +412 kJ·mol-1B. -412 kJ·mol-1C. +236 kJ·mol-1D. -236 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】最近,科学家研发了“全氢电池”,其工作原理如图所示。下列有关该电池工作时的说法,正确的是( )
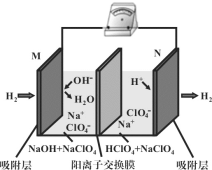
A. 电解质溶液中,Na+向左移动
B. 该电池的总反应为H+ + OH- = H2O
C. 电子由N电极经导线流向M电极
D. 导线上通过1mole-,装置内H2总量减少0.5mol
查看答案和解析>>
科目: 来源: 题型:
【题目】已知破坏1 mol A—A键、1 mol B—B键、1 mol A—B键时分别需要吸收436 kJ、498 kJ、463 kJ的能量。反应2A2+B2![]() 2A2B的能量变化关系如图所示。下列说法中错误的是( )。
2A2B的能量变化关系如图所示。下列说法中错误的是( )。
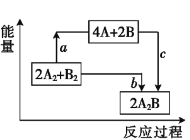
A. a=1370 kJB. b=482 kJ
C. 该反应是吸热反应D. 体系中A、B原子最活泼
查看答案和解析>>
科目: 来源: 题型:
【题目】将8.0 g铁粉加入到100 mL 2.0 mol/L FeCl3溶液中,发生反应为Fe+2Fe3+=3Fe2+,反应后过滤、洗涤、烘干得固体质量为m。下列说法不正确的是( )
A.m=2.4gB.Fe3+在反应中做氧化剂,失去0.2mol电子
C.该反应是化合反应D.反应后溶液中n(Fe2+)=0.3 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,2.24 L乙醇中含有的氧原子数目为0.1NA
B.1 L 1mol/L的NaHCO3溶液中Na+、H+和CO32-的数目均为NA
C.16 g的O2和O3混合气体中所含原子总数为NA
D.18 g水中所含电子总数为8NA
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此,下列说法正确的是( )
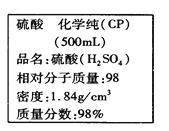
A. 该硫酸的物质的量浓度为9.2 mol·L-1
B. 该硫酸与等体积的水混合所得溶液的质量分数小于49%
C. 配制250mL 4.6 mol·L-1的稀硫酸需取该硫酸62.5mL
D. 该硫酸50.0mL与足量的铜反应可得到标准状况下SO2气体10.304 L
查看答案和解析>>
科目: 来源: 题型:
【题目】已知NH4HCO3![]() NH3↑+CO2↑+H2O↑。为了将混有硫酸钠、碳酸氢铵的NaCl提纯,并制得纯净的NaCl溶液,某学生设计如下实验方案:
NH3↑+CO2↑+H2O↑。为了将混有硫酸钠、碳酸氢铵的NaCl提纯,并制得纯净的NaCl溶液,某学生设计如下实验方案:
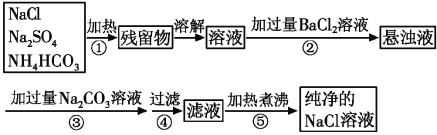
(1)操作④中所需的玻璃仪器有_________________________________。
(2)操作②为什么不用硝酸钡溶液,其理由是________________________________。
(3)进行操作②后,如何判断SO![]() 已除尽,方法是___________________________。
已除尽,方法是___________________________。
(4)操作③的目的是__________,其相应的离子方程式为:____________________。
(5)说明此设计方案不严密之处____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】乳酸亚铁晶体[CH3CH(OH)COO]2Fe·3H2O(M=288)是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸CH3CH(OH)COOH与FeCO3反应制得:
I.制备碳酸亚铁
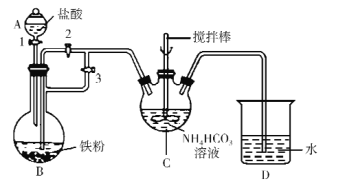
(1)仪器C的名称是_____。
(2)利用如图所示装置进行实验。首先关闭活塞2,打开活塞1、3,目的是____;关闭活塞1,反应一段时间后,关闭活塞____,打开活塞______,观察到B中溶液进入到C中,C中产生沉淀和气体,写出制备FeCO3的离子方程式____。
(3)装置D的作用是____。
Ⅱ.乳酸亚铁晶体的制备及纯度测定
将制得的FeCO3加入到乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应。然后再加入适量乳酸,从所得溶液中获得乳酸亚铁晶体。
(4)加入少量铁粉的作用是_____。
(5)若用KMnO4滴定法测定样品中Fe2+的量进而计算纯度时,发现结果总是大于100%,其主要原因是_________。
(6)经查阅文献后,改用Ce(SO4)2标准溶液进行滴定。反应中Ce4+离子的还原产物为Ce3+。测定时,先称取5.760g样品,溶解后进行必要处理,用容量瓶配制成250 mL溶液,每次取25.00mL,用0.1000mol·L-1Ce(SO4)2标准溶液滴定至终点,记录数据如下表所示。
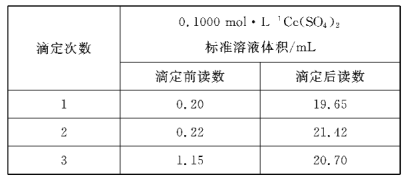
则产品中乳酸亚铁晶体的纯度为___%(保留小数点后两位)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法错误的是( )
A. 若把H2S分子写成H3S分子,违背了共价键的饱和性
B. H3O+离子中存在配位键
C. 已知X、Y元素同周期,且电负性X>Y, 第一电离能X一定大于Y
D. 在面心立方堆积的金属晶体中,属于1个晶胞的金属原子有4个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com