
科目: 来源: 题型:
【题目】某试剂瓶上贴有如下标签“100mL 1.0molL-1MgCl2 溶液”,对该试剂理解正确的是( )
A.该溶液中含有的微粒主要有:MgCl2、Mg2+、Cl-、H2O
B.若取 50mL 溶液,其中的 c(Cl-)=1 molL﹣1
C.取该溶液5.0 mL恰好与0.1 molL-1 AgNO3100 mL溶液完全反应
D.取10mL该溶液加水10 mL,所得MgCl2溶液的浓度为0.5 molL-1
查看答案和解析>>
科目: 来源: 题型:
【题目】不列离子方程式书写正确的是
A. 铜片与稀硝酸反应:3Cu+2NO3-+8H+=3Cu2++2NO2↑+4H2O
B. 将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O
C. 碳酸氢钙溶液中加入少量的氢氧化钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
D. 用浓氢氧化钠溶液检验溶液中的NH4+:NH4++OH-![]() NH3·H2O
NH3·H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列属于置换反应且氧化剂与还原剂的物质的量之比为2∶1的是( )
A.2KI + Cl2 = 2KCl + I2B.2Mg + CO2 ![]() 2MgO + C
2MgO + C
C.TiO2 + 2Cl2 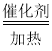 TiCl4+O2D.2FeCl3 + Cu=2FeCl2 + CuCl2
TiCl4+O2D.2FeCl3 + Cu=2FeCl2 + CuCl2
查看答案和解析>>
科目: 来源: 题型:
【题目】将10mL98%浓硫酸(密度为1.84g/mL)加水稀释至1L,然后向溶液中加入6.5g锌粒。
(1)稀释后硫酸溶液中H+的物质的量浓度是_________________?
(2)标出反应中电子转移方向及数目___________,并计算生成气体在标况下的体积是_____________?
查看答案和解析>>
科目: 来源: 题型:
【题目】我国是世界上最大的钨储藏国,金属钨可用于制造灯丝、合金钢和光学仪器,有“光明使者”的美誉,现以白钨矿(主要成分为CaWO4,还含有二氧化硅、氧化铁等杂质)为原料冶炼高纯度金属钨,工业流程如图:
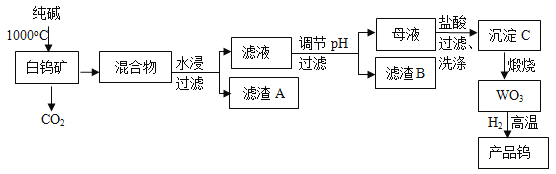
已知:①钨酸酸性很弱,难溶于水;
②完全沉淀离子的pH值:SiO32﹣为8,WO42﹣为5;
③碳和金属钨在高温下会反应生成碳化钨。
回答下列问题:
(1)工业上生产纯碱常先制得碳酸氢钠,此法叫“联碱法”,为我国化工专家侯德榜创立,即向饱和食盐水中先通入NH3,再通入CO2,最终生成碳酸氢钠晶体和氯化铵溶液,写出该化学反应方程式:____。
(2)流程中白钨矿CaWO4和纯碱发生的化学反应方程式是:____。
(3)滤渣B的主要成分是(写化学式)___。调节pH可选用的试剂是:__(填选项)。
A.氨水 B.盐酸 C.NaOH溶液 D.Na2CO3溶液
(4)检验沉淀C已经洗涤干净的操作是____。
(5)为了获得可以拉制灯丝的高纯度金属钨,不宜用碳而必须用氢气作还原剂的原因是:___。
(6)将氢氧化钙加入钨酸钠碱性溶液中可得到钨酸钙,已知某温度时,Ksp(CaWO4)=1×10﹣10,Ksp[Ca(OH)2]=4×10﹣7,当溶液中WO42﹣恰好沉淀完全(离子浓度等于10﹣5mol/L)时,溶液中c(OH﹣)=____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列是MnO2工业制备及对含Mn2+废水处理的有关问题,已知:Ksp[Mn(OH)2]=1.9×10-13 , Ksp(MnCO3)=2.2×10-11,回答下列问题:
(1)用惰性电极电解MnSO4溶液可制备MnO2,其阳极反应式为___________。
(2)往MnSO4溶液中加入(NH4)2CO3溶液制取MnCO3时会产生Mn(OH)2,可能的原因是:MnCO3(s)+2OH-(aq) ![]() Mn(OH)2(s)+CO32-(aq),该反应的平衡常数K=_________(保留一位小数)。
Mn(OH)2(s)+CO32-(aq),该反应的平衡常数K=_________(保留一位小数)。
(3)废水中的Mn2+,也可用NH4HSO4调节溶液的pH。室温时,往100 mL 0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,所得溶液的pH与所加NaOH溶液体积的关系曲线如下图所示 (反应前后溶液总体积变化忽略不计) 。
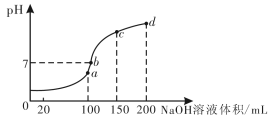
a点c(NH4+)+c(NH3 .H2O)=__________mol·L-1 ;图中a、b、c、d四个点,水的电离程度最大的是__________;b点,溶液中各离子浓度由大到小的排列顺序是____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在中学化学中,KMnO4是常见的氧化剂之一。某实验小组收集整理了相关知识:
(1) KMnO4中Mn的化合价为_______。
(2) 实验室中可以加热分解KMnO4制取O2,其反应方程式为_______________。
(3) 实验中常在KMnO4溶液中加入适量稀硫酸,增加KMnO4的氧化性,但不宜用盐酸酸化,因为浓度较大时,KMnO4可能将Cl-氧化成Cl2,该反应中氧化剂和还原剂的物质的量之比为:____________ ,比较以下两种物质的氧化性:KMnO4_____________于Cl2(填“强”或“弱”)
(4) H2C2O4(草酸)是生物体的一种代谢产物,生活中常用作还原剂、除锈剂,将H2C2O4溶液滴入硫酸酸化的KMnO4溶液,当KMnO4被完全还原时,溶液颜色由_______变成无色,同时有无色气体生成。该反应方程式为:_____________________。
(5)某同学将KMnO4溶液加入H2O2溶液,却忘记了滴入稀硫酸,片刻后,有气泡产生,且出现黑色沉淀。该沉淀化学式为____________________
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室需要750 mL 0.16 mol·L-1的NaCl溶液,有如下操作步骤:
A. 把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解,冷却至室温
B. 继续向容量瓶中加蒸馏水至液面距刻度线以下1~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切
C. 用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶
D. 把A所得溶液小心转入一定容积的容量瓶中
E. 将容量瓶瓶塞塞紧,充分摇匀
请填写下列空白:
(1)简述容量瓶使用前必须进行的操作________________________________
(2)操作步骤的顺序为____________________(填序号)。
(3)实验室有如下规格的容量瓶:a.100 mL,B. 250 mL,C. 500 mL,d. 1000 mL,本实验选用__________(填序号)。
(4)本实验用到的基本实验仪器除容量瓶、药匙、玻璃棒、烧杯、量筒、胶头滴管外,还必须用到的仪器有____________,实验中玻璃棒的作用是_________________。
(5)本实验需用托盘天平称取NaCl晶体的质量是___________g。
(6)误差分析(填“偏高”“偏低”或“无影响”):
A. 某同学试验时未洗涤烧杯:____________。
B. 某同学观察液面的情况如图所示:____________。

C. 称取的食盐中混有Na2CO3杂质:___________。
(7) 已知所得溶液密度为1.04 g/mL,则所得溶液的质量分数为:___________
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)某种原子的质量是a g,若NA只表示阿伏伽德罗常数的数值,该原子的相对原子质量为______,b g该原子的物质的量为______mol。
(2)a g A气体与b g B气体分子数相等,同温同压下,气体A与气体B的密度之比为___________。
(3)向10 mL 0.1mol/LNaHCO3溶液中缓缓滴入0.1mol/LCa(OH)2溶液,首先发生反应的两种离子为____________(填离子符号,下同),随后溶液中有白色沉淀生成,生成沉淀的两种离子为____________。当加入少量Ca(OH)2溶液时,发生的离子反应方程式为_______________________。
(4) 将3.22 g芒硝(Na2SO4·10H2O)溶于水中,要使每100个水分子中溶有1个Na+,则需加入水的质量为___g。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F六种短周期主族元素,其原子序数依次增大,其中:C元素的原子最外层电子数是次外层电子数的三倍;A与D、C与F同主族;D是所在周期原子半径最大的主族元素,又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)元素D在周期表中的位置_____________。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是_______(用离子符号表示)。
(3)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X,X中所含化学键类型有_____。
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:_____;若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:_____。
(5)FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的化学方程式___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com