
科目: 来源: 题型:
【题目】已知化合物X由3种元素组成,某学习小组进行了如下实验:
①取适量X,加水完全溶解,无气体产生,溶液呈碱性;进行焰色反应,透过蓝色钴玻璃观察到火焰呈紫色;
②取1.685gX溶于水,加入含HCl 0.02000mol的盐酸恰好中和;中和后的溶液与硝酸酸化的过量AgNO3溶液反应,得到4.305g白色沉淀。
请回答:
(1)X中3种元素是____________(用元素符号表示);
(2)X与水反应的化学方程式是______________;
(3)X中一种元素对应的单质,可与石灰乳反应得到漂白粉,写出该反应的化学方程式:_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】H2S的分解反应是一个可逆反应,其能量与反应进程的关系如图所示,下列有关说法正确的是( )

A. 正反应的活化能大于逆反应的活化能
B. 若减小体系的压强,则该反应的焓变将增大
C. 升高温度,化学反应速率加快,H2S的平衡转化率减小
D. 向密闭容器中充入1molH2S充分反应,吸收84.9kJ的热量
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.已知亚硝酸钠能发生如下反应:2NaNO2+ 4HI= 2NO + I2 + 2NaI + 2H2O
(1)用双线桥表示电子转移的方向与数目__________。
(2)若有1mol还原剂被氧化,则在此反应中发生转移的电子数目为_________。
II.已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O
(1)该反应中还原产物为__________。
(2)每生成2molCuI,有__________mol KI被IO3-氧化。
查看答案和解析>>
科目: 来源: 题型:
【题目】人工肾脏可用间接电化学方法除去代谢产物中的尿素 CO(NH2)2,原理如图。下列有关说法正确的是
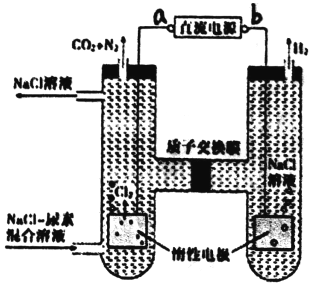
A. a为电源的负极
B. 电解前后,阴极室溶液的pH不变
C. 阳极室中发生的电极反应为2H++2e-=H2↑
D. 若两极共收集到气体产品13.44L,则除去的尿素为7.2g(忽略气体的溶解)
查看答案和解析>>
科目: 来源: 题型:
【题目】无水氯化锌常用作有机合成的催化剂。实验室采用HCl气体除水、ZnCl2升华相结合的方法提纯市售氯化锌样品(部分潮解并含高纯高温不分解杂质)。实验装置如图所示:
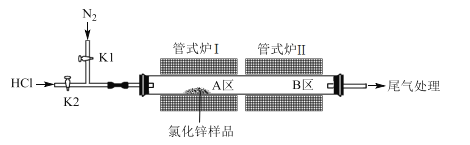
回答下列问题:
(1)无水氯化锌在空气中易潮解生成Zn(OH)Cl的化学方程式为_____。
(2)除水阶段:打开K1,K2。将管式炉I、II升温至150 ℃,反应一段时间后将管式炉I、II的温度升至350 ℃,保证将水除尽。除水阶段发生反应的化学方程式为 ____。
(3)升华阶段:撤去管式炉II,将管式炉I迅速升温至750℃,升温的目的是_____。一段时间后关闭管式炉I并关闭 ____(填K1或K2),待冷却后关闭 ____(填K1或K2)。最后将_____(填A或B)区的氯化锌转移、保存。
(4)除水阶段HCl与 N2流速要快,有利于提高除水效率。升华阶段HCl与N2流速要慢,其原因是_____。
(5)测定市售ZnCl2样品中的锌的质量分数。步骤如下:
① 溶液配制:称取m g样品,加水和盐酸至样品溶解,转移至250 mL的 ____中,加蒸馏水至刻度线,摇匀。
② 滴定:取25.00mL待测液于锥形瓶中,用c mol·L-1K4[Fe(CN)6]标准溶液滴定至终点,消耗V mL。滴定反应为:2K4[Fe(CN)6]+3ZnCl2=K2Zn3[Fe(CN)6]2↓+6KCl该样品中锌的质量分数为 ____。
查看答案和解析>>
科目: 来源: 题型:
【题目】MnO2是一种重要的化工原料,可用于合成工业的催化剂和氧化剂。采用软锰矿(主要成分为MnO2)可制备高纯MnO2,其流程如下:

下列叙述错误的是
A. “含Mn2+、A13+的溶液”中还含Fe3+
B. 加入“氨水”同时搅拌,搅拌的目的是提高反应速率
C. “滤渣”可完全溶解在NaOH溶液中
D. 电解含Mn2+的溶液,MnO2为阳极产物
查看答案和解析>>
科目: 来源: 题型:
【题目】有一种节能的氯碱工业新工艺,将电解池与燃料电池相组合,相关流程如下图所示(电极未标出),下列说法错误的是:
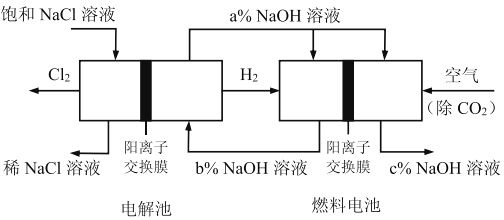
A. 电解池的阴极反应式2H2O+2e-=H2+2OH-
B. 相同条件下,当电解池生成2LCl2,理论上燃料电池应消耗1LO2
C. 电解池中阳离子移动流向阴极池
D. 溶液a、b、c的pH大小顺序为:a>b>c
查看答案和解析>>
科目: 来源: 题型:
【题目】用化学用语表示:
(1)根据下列几种粒子的结构示意图,回答问题:

①写出B微粒的符号_________;
②若A微粒的中子数为10,写出表示A微粒的组成符号________;
③写出A、C、D三种元素形成的某种化合物在水溶液中的电离方程式:_________;
(2)写出下列反应的化学方程式:
①氯化铵与氢氧化钠共热____________;
②工业上制备氯气____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等)来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程,关于该流程下列说法正确的是( )
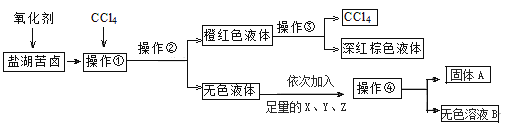
A.操作①、③对应的分别是萃取、分液
B.操作④需要的主要玻璃仪器除烧杯外,还需要蒸馏烧瓶
C.X、Y、Z 可以分别是BaCl2、KOH、K2CO3
D.要得到纯净的氯化钾晶体,必须在无色溶液B中加入稀硫酸至中性,然后蒸发结晶即可
查看答案和解析>>
科目: 来源: 题型:
【题目】以铜为原料可制备应用广泛的氧化亚铜。
(1)向CuCl2溶液中通入SO2可得到CuCl沉淀,发生反应的化学方程式为:____。
(2)由CuCl水解再热分解可得到纳米Cu2O。CuCl水解为:CuCl(s)+H2O(l)![]() CuOH(s)+Cl-(aq)+H+(aq)。该反应的平衡常数K与此温度下KW、Ksp(CuOH)、Ksp(CuCl)的关系为K=___。
CuOH(s)+Cl-(aq)+H+(aq)。该反应的平衡常数K与此温度下KW、Ksp(CuOH)、Ksp(CuCl)的关系为K=___。
(3)用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,阳极及其溶液中有关转化如图1所示。溶液中③、④二步总反应的离子方程式为:___。
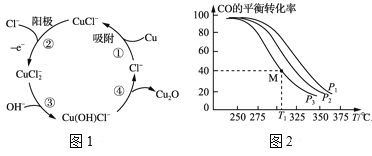
(4)Cu2O与ZnO组成的催化剂可用于工业上合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) ΔH=a kJ·mol-1。按n(H2)/n(CO)=2:1投料比将H2与CO充入V L恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图2所示。
CH3OH(g) ΔH=a kJ·mol-1。按n(H2)/n(CO)=2:1投料比将H2与CO充入V L恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图2所示。
①该反应的ΔH___0(填“<”或“>”),图中压强P1、P2、P3由大到小的关系是___。
②起始时,容器中c(H2)=0.20mol·L-1,c(CO)=0.10mol·L-1,在P3及T1℃下反应达到平衡,此时反应的平衡常数为___。(保留一位小数)
起始时,若容器中c(H2)=0.40mol·L-1,c(CO)=0.20mol·L-1,T1℃下反应达到平衡,CO的平衡转化率____。
A.大于40% B.小于40% C.等于40% D.等于80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com