
科目: 来源: 题型:
【题目】在温度相同、容积均为2 L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下。下列说法正确的是
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1mo N2、3mol H2 | 2mol N2、6mol H2 | 2mol NH3 |
NH3浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | 放出Q1kJ | 放出Q2kJ | 吸收Q3kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
A. 2p1=2p3<p2 B. 达到平衡时丙容器中NH3的体积分数最大
C. α2+α3<1 D. Q1+Q3=92.4
查看答案和解析>>
科目: 来源: 题型:
【题目】写出下列反应的化学方程式
(1)氯气和水反应:_____________________________ ;
(2)Ca(ClO)2+CO2+H2O:___________________________ ;
(3)工业上制取氯气:________________________________ ;
(4)工业制漂白粉:__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,Ka(CH3COOH)=1.7×10-5。该温度下,用0.1mol/L的醋酸溶液滴定10.00mL 0.1mol/L的MOH溶液,滴定过程中加入醋酸溶液的体积(V)与溶液中lg[c(H+)/c(OH-)]的关系如图所示(V=0时,lg[c(H+)c(OH-)]=-12)。下列说法不正确的是
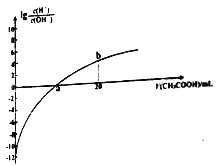
A. MOH是一元强碱
B. a 点:V(CH3COOH)=10.00mL
C. b R:c(M+)>(CH3COOH)>C(H+)>c(OH-)
D. 25℃时,CH3COO-的水解平衡常数约为5.9×10-10
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是一种正投入生产的大型蓄电系统,放电前,被膜隔开的电解质为Na2S2和NaBr3,放电后分别变为Na2S4和NaBr。下列叙述正确的是( )
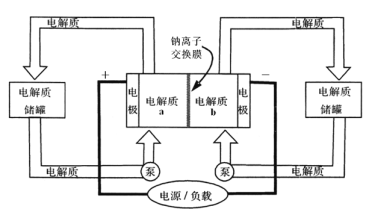
A. 放电时,负极反应为3NaBr-2e-=NaBr3+2Na+
B. 充电时,阳极反应为2Na2S2-2e-=Na2S4+2Na+
C. 放电时,Na+经过离子交换膜,由b池移向a池
D. 用该电池电解饱和食盐水,产生2.24 L H2时,b池生成17.40gNa2S4
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写不正确的是
A. 向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2===I2+2H2O
B. 碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH-===BaCO3↓+H2O
C. 向Al2(SO4)3溶液中加入过量的氨水:Al3++4NH3·H2O===AlO2-+4NH4++2H2O
D. 用铁棒作阴极,碳棒作阳极电解饱和氯化钠溶液:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】黄铁矿(主要成分为FeS2)的利用对资源和环境具有重要意义。
(1)工业上煅烧黄铁矿可制取SO2。已知下列热化学方程式
4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g) △H=akJ/mol
S(s)+O2(g)=SO2(g) △H=bkJ/mol
Fe(s)+2S(s)=FeS2(s) △H=ckJ/mol
则4Fe(s)+3O2(g)=2Fe2O3(s) △H=_____kJ/mol
(2)一种酸性条件下催化氧化黄铁矿的物质转化关系如图I所示。
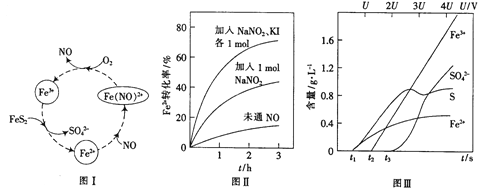
(1)写出如图中Fe3+与FeS2反应的离子方程式:______________。
(2)硝酸也可将FeS2氧化为Fe3+和SO42-,使用浓硝酸比使用稀硝酸反应速率慢,其原因是______________。
(3)控制Fe2+的浓度、溶液体积和通入O2的速率一定,图II所示为改变其他条件时Fe2+被氧化的转化率随时间的变化。
① 加入NaNO2发生反应:2H++3NO2-=NO3-+2NO+H2O。若1mol NaNO2完全反应则转移电子的数目为______mol。
② 加入NaNO2、KI发生反应:4H++2NO2-+2I-=2NO+I2+2H2O。解释图II中该条件下能进一步提高单位时间内Fe2+转化率的原因:______________。
(4)为研究FeS2作电极时的放电规律,以FeS2作阳极进行电解,由FeS2放电产生粒子的含量与时间、电压(U)的关系如图III所示。
①写出t1至t2间FeS2所发生的电极反应式:__________。
②当电压的值介于3U~4U之间,FeS2放电所得主要粒子为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机玻璃的单体甲基丙烯酸甲酯(MMA) 的合成原理如下:
 (MMA)
(MMA)
下列说法正确的是
A. 若反应①的原子利用率为100%,则物质X为CO2
B. 可用分液漏斗分离MMA和甲醇
C. ![]() 、
、![]() 均可发生加成反应、氧化反应、取代反应
均可发生加成反应、氧化反应、取代反应
D. MMA与H2反应生成Y,能与NaHCO3溶液反应的Y的同分异构体有3种
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验原理或操作正确的是

A. 选择合适的试剂,用图甲可分别制取少量CO2、CO和SO2
B. 洗涤沉淀时(见图乙),向漏斗中加入适量水至浸没沉淀并滤干,重复2-3次
C. 用图丙所示装置除去HCl中的少量CO2
D. 用图丁装置从KI和I2的固体混合物中回收I2
查看答案和解析>>
科目: 来源: 题型:
【题目】如下图所示装置是一种可充电电池,装置Ⅱ为电解池.好交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3 ![]() Na2S4+3NaBr。闭合开关K时,b极附近先变红色。下列说法正确的是
Na2S4+3NaBr。闭合开关K时,b极附近先变红色。下列说法正确的是
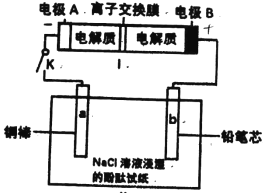
A. 闭合K后,a电极上有气体产生
B. 装置I中电子由B经过交换膜移向A
C. 装置I充电时,电极A的电极反应式:2Na2S2—2e-=Na2S4+2Na+
D. 当有0.01molNa+通过离子交换膜时,b电极上析出标准状况下的气体112mL
查看答案和解析>>
科目: 来源: 题型:
【题目】煤的液化可以合成甲醇。
①“气化”:C(s)+2H20(g)=C02(g)+2H2(g) △H1=+90.1kJ·mol-1
②催化液化Ⅰ:CO2(g)+3H2(g)=CH30H(g)+H20(g)△H2=-49.0kJ·mol-1
③催化液化Ⅱ:C02(g)+2H2(g)=CH30H(g)+1/2O2(g)△H3=akJ·mol-1
下列有关说法正确的是

A. 催化液化Ⅰ中使用催化剂,反应的活化能Ea、△H2都减小
B. 反应C(s)+H20(g)+H2(g)=CH3OH(g) △H=+41.1kJ·mol-1
C. △H2>△H3
D. 甲醇燃料电池的工作原理示意图如图所示,负极的电极反应为CH3OH-6e-+6OH-=CO2↑+5H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com