
科目: 来源: 题型:
【题目】氮化铬(CrN)是一种良好的耐磨材料,实验室可用无水氯化铬(CrCl3)与氨气在高温下反应制备,反应原理为CrCl3+NH3![]() CrN+3HCl.回答下列问题:
CrN+3HCl.回答下列问题:
(1)制备无水氯化铬。氯化铬有很强的吸水性,通常以氯化铬晶体(CrCl3·6H2O)的形式存在。直接加热脱水往往得到Cr2O3,有关反应的化学方程式为______________,以氯化铬晶体制备无水氯化铬的方法是_____________________________。
(2)制备氮化铬。某实验小组设计制备氮化铬的装置如下图所示(夹持与加热装置省略):
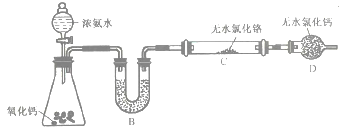
①装置A中发生反应的化学方程式为_____________________。
②实验开始时,要先打开装置A中活塞,后加热装置C,目的是___________________。
③装置B中盛放的试剂是____________,装置D的作用是_____________________。
④有同学认为该装置有一个缺陷,该缺陷是_______________________。
(3)氯化铬的纯度测定。制得的CrN中含有Cr2N杂质,取样品14.38g在空气中充分加热,得固体残渣(Cr2O3)的质量为16.72g,则样品中CrN的质量分数为_____________(结果保留3位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】将以下4份溶液分别置于如图的装置中,其它条件相同时,灯泡最亮的是
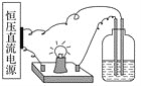
A. 100 mL 1 mol·L-1的盐酸
B. 100 mL 2 mol·L-1的蔗糖溶液
C. 100 mL 1 mol·L-1的醋酸溶液
D. 30 mL 1 mol·L-1的氯化铝溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 分子式为CH4O和C2H6O的物质一定互为同系物
B. 甲烷、乙烯和苯在工业上都可通过石油分馏得到
C. 苯酚钠溶液中通入少量二氧化碳生成苯酚和碳酸钠
D. 1 mol![]() 与过量的NaOH溶液加热充分反应,能消耗5 mol NaOH
与过量的NaOH溶液加热充分反应,能消耗5 mol NaOH
查看答案和解析>>
科目: 来源: 题型:
【题目】砷和镍均为重要的无机材料,在化工领域具有广泛的应用。
(1)基态As原子的价层电子的电子云轮廓图形状为_____________。与砷同周期的主族元素的基态原子中,第一电离能最大的为_____________(填元素符号。)
(2)Na3AsO3可用于碘的微量分析。
①Na+的焰色反应呈黄色,金属元素能产生焰色反应的微观原因为__________________________。
②Na3AsO3中所含阴离子的立体构型为_____________,写出一种与其互为等电子体的分子:_____________(填化学式)。
(3)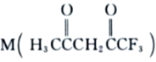 可用于合成Ni2+的配体,M中C原子的杂化方式为___________,其所含
可用于合成Ni2+的配体,M中C原子的杂化方式为___________,其所含![]() 键和π键的数目之比为___________。
键和π键的数目之比为___________。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为___________。区分晶体Ni和非晶体Ni的最可靠的科学方法为___________。
(5)某砷镍合金的晶胞结构如下图所示,设阿伏加德罗常数的值为NA,则该晶体的密度ρ=___________g·cm-3。

查看答案和解析>>
科目: 来源: 题型:
【题目】唐山市打造“山水园林城市”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:
SO2(g)+NH3·H2O(aq)![]() NH4HSO3(aq) ΔH1=a kJ·mol1;
NH4HSO3(aq) ΔH1=a kJ·mol1;
NH3·H2O(aq)+ NH4HSO3(aq)![]() (NH4)2SO3(ag)+H2O(l) ΔH 2=b kJ·mol1;
(NH4)2SO3(ag)+H2O(l) ΔH 2=b kJ·mol1;
2(NH4)2SO3(aq)+O2(g)![]() 2(NH4)2SO4(aq) ΔH 3=c kJ·mol1。
2(NH4)2SO4(aq) ΔH 3=c kJ·mol1。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g) ![]() 2(NH4)2SO4(aq)+2H2O(l)的ΔH =____kJ·mol1。
2(NH4)2SO4(aq)+2H2O(l)的ΔH =____kJ·mol1。
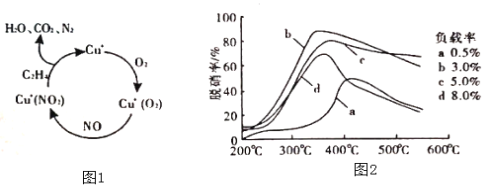
(2)以乙烯(C2H4)作为还原剂脱硝(NO),脱硝机理如图1,则总反应的化学方程式为_______;脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2,为达到最佳脱硝效果,应采用的条件是______。
(3)T1温度时在容积为2L的恒容密闭容器中发生反应:2NO(g)+O2(g)![]() 2NO2(g) △H<0。实验测得:υ正=υ(NO)消耗=2υ(O2)消耗=k正c2(NO)·c(O2),υ逆=(NO2) 消耗=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
2NO2(g) △H<0。实验测得:υ正=υ(NO)消耗=2υ(O2)消耗=k正c2(NO)·c(O2),υ逆=(NO2) 消耗=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 1 | 0.6 | 0.4 | 0.2 | 0.2 | 0.2 |
n(O2)/mol | 0.6 | 0.4 | 0.3 | 0.2 | 0.2 | 0.2 |
①T1温度时k正/k逆=__________ L/mol。
②若将容器的温度改变为T2时其k正=k逆,则T2__________T1(填“>”、“<”或“=")。
(4)已知:N2(g)+O2(g)![]() 2NO(g) △H=+181.5 kJ·mol-1,某科研小组尝试利用固体表面催化工艺进行NO的分解。若用
2NO(g) △H=+181.5 kJ·mol-1,某科研小组尝试利用固体表面催化工艺进行NO的分解。若用![]() 、
、![]() 、
、![]() 和
和![]() 分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是___(填字母序号)。
分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是___(填字母序号)。
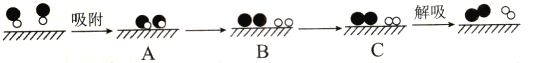
(5)利用电解法处理高温空气中稀薄的NO(O2浓度约为NO浓度的10倍),装置示意图如下,固体电解质可传导O2-
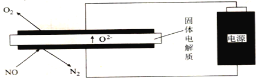
①阴极的电极反应式为______。
②消除一定量的NO所消耗的电量远远大于理论计算量,可能的原因是(不考虑物理因素)_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应
B. 分子式为C4H7ClO2,可与NaHCO3产生CO2的有机物可能结构有3种
C. 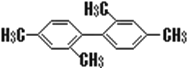 分子中至少有11个碳原子处于同一平面上
分子中至少有11个碳原子处于同一平面上
D. 1mol有机物 一定条件下能和7molNaOH反应。
一定条件下能和7molNaOH反应。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,改变0.1mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数![]() (X)随pH的变化如图所示[已知
(X)随pH的变化如图所示[已知![]() (X) =
(X) =![]() ]。下列叙述错误的是( )
]。下列叙述错误的是( )

A. pH=1.2时,c(K+)+c(H+)=c(H2A)+c(OH-)
B. 常温下,H2A的电离平衡常数Ka2=10-42
C. pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D. KHA溶液中离子浓度为c(K+)>c(HA-)>c(OH-)>c(H2A)>c(H+)>c(A2-)
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定质量的KI和KCl固体混合物溶于水形成1000mL溶液,K+浓度为0.5mol·L-1,若向其中通入足量的Cl2,完全反应后将所得溶液蒸干,灼烧得到固体残留物比原固体混合物质量减少18.3g。
试计算:
(1)原固体混合物中KI的质量?___
(2)固体残留物中含有什么物质?___其物质的量是多少?___
查看答案和解析>>
科目: 来源: 题型:
【题目】菲斯科(FiskerInc.)公司宣布正在开发的固态锂电池能量密度是现有电池的2.5倍,续航里程可达500英里(约804公里),最快充电时间可以分钟计,钴酸锂(LiCoO2) 电池的工作原理如图所示,M极材料是金属锂和碳的复合材料(碳作金属锂的载体),电解质为一种能传导Li+的高分子材料。隔膜只允许特定的离子通过。下列说法正确的是
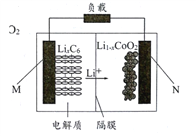
A. 电池的总反应式为:LixC6+Li1-xCoO2==C6+LiCoO2
B. M为电池的正极
C. 放电时,N为负极,电极发生氧化反应
D. 充电时,M为阳极,电极发生氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com