
科目: 来源: 题型:
【题目】钴元素是三元锂离子电池阳极材料的重要成分。请回答下列问题:
(1)钴元素在周期表中的位置是_______,其价电子排布式为______。
(2)第四电离能大小:I4(Fe)> I4(Co),从原子结构的角度分析可能的原因是____。
(3)取1mol配合物CoCl3·6NH3(黄色)溶于水,加入足量硝酸银溶液,产生3mol白色沉淀,沉淀不溶于稀硝酸。原配合物中络离子形状为正八面体。
①根据上述事实推测原配合物中络离子化学式为_______。
②该配合物在热NaOH溶液中发生反应,并释放出气体,该反应的化学方程式_____;生成气体分子的中心原子杂化方式为____。
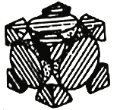
(4)经X射线衍射测定发现,晶体钴在417℃以上堆积方式的剖面图如图所示,则该堆积方式属于_____,若该堆积方式下钴原子的半径为r,则该晶体的空间利用率为______(列出表达式并写出最终结果)。
查看答案和解析>>
科目: 来源: 题型:
【题目】有关晶体的结构如下图所示,下列说法中不正确的是( )
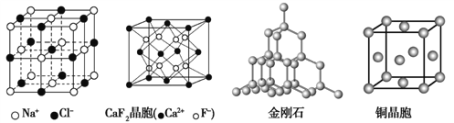
A. 在NaCl晶体中,距Na+最近的Cl-形成正八面体
B. 在CaF2晶体中,每个晶胞平均占有4个Ca2+
C. 在金刚石晶体中,碳原子数与碳碳键个数的比为1:4
D. 铜晶体为面心立方最密堆积,该晶体中面对角线长度为原子半径的4倍
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 78gNa2O2晶体中所含阴阳离子个数为2NA
B. 1.5gCH3+中含有的电子数为NA
C. 3.4g氨气分子中含有0.6NA个N—H键
D. 常温下,100mL1mol·L-1AlCl3溶液中Al3+离子总数等于0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】白磷有剧毒,白磷中毒可用硫酸铜溶液解毒,白磷与硫酸铜可以发生如下两个反应:
(1)2P+5CuSO4+8H2O![]() 5Cu+2H3PO4+5H2SO4
5Cu+2H3PO4+5H2SO4
(2)11P+15CuSO4 +24H2O![]() 5Cu3P+6H3PO4+15H2SO4
5Cu3P+6H3PO4+15H2SO4
下列有关说法中错误的是( )
A. 上述两个反应中,水既不是氧化剂也不是还原剂
B. 上述两个反应中,氧化剂都只有硫酸铜
C. 上述两个反应中,氧化产物都是H3PO4
D. 反应(2)中,1molCuSO4可氧化1/5molP
查看答案和解析>>
科目: 来源: 题型:
【题目】在给定条件下,下列选项中所示的物质间转化能一步实现的是( )
A.Fe![]() Fe2O3
Fe2O3![]() Fe(OH)3B.Mg(OH)2
Fe(OH)3B.Mg(OH)2![]() MgCl2溶液
MgCl2溶液![]() Mg
Mg
C.NH3![]() NO
NO![]() NO2D.SO2
NO2D.SO2![]() (NH4)2SO4
(NH4)2SO4![]() BaSO4
BaSO4
查看答案和解析>>
科目: 来源: 题型:
【题目】据科技日报网报道南开大学科研团队借助镍和苯基硼酸共催化剂,首次实现丙烯醇高效、绿色合成。丙烯醇及其化合物可合成甘油、医药、农药、香料,合成维生素E和KI及天然抗癌药物紫杉醇中都含有关键的丙烯醇结构。丙烯醇的结构简式为CH2=CH-CH2OH。请回答下列问题:
(1)基态镍原子的电子排布式为____________________________________________。
(2)1 mol CH2=CH-CH2OH中σ键和π键的个数比为___________,丙烯醇分子中碳原子的杂化类型为___________。
(3)丙醛(CH3CH2CHO的沸点为49℃,丙烯醇(CH2=CHCH2OH)的沸点为91℃,二者相对分子质量相等,沸点相差较大的主要原因是______________________。
(4)羰基镍[Ni(CO)4]用于制备高纯度镍粉,它的熔点为-25℃,沸点为43℃。羰基镍晶体类型是___________。
(5)Ni2+能形成多种配离子,如[Ni(NH3)6]2+、[Ni(SCN)3]-和[Ni(CN)4]2-等。[Ni(NH3)6]2+中心原子的配位数是___________ ,与SCN-互为等电子体的分子为___________。
(6)“NiO”晶胞如图所示。

①氧化镍晶胞中原子坐标参数:A(0,0,0)、B(1,1,0),则C原子坐标参数为___________。
②已知:氧化镍晶胞密度为dg/cm3,NA代表阿伏加德罗常数的值,则Ni2+半径为___________nm(用代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。关于这两种晶体的说法,正确的是
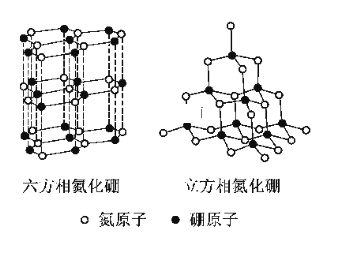
A. 立方相氮化硼含有σ键和π键,所以硬度大
B. 六方相氮化硼层间作用力小,所以质地软
C. 两种晶体中的B原子的杂化类型相同
D. 两种晶体均为分子晶体
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式中书写正确的是( )
A.Na2CO3稀溶液中通入少量CO2:CO2+CO32-+H2O=2HCO![]()
B.向氯化铁溶液中加入铁粉:Fe3++Fe=2Fe2+
C.大理石溶于盐酸:CaCO3+2HCl=Ca2++CO2↑+H2O+2Cl-
D.铁粉投入稀硝酸:Fe+2H+=Fe2++H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】镍与VA族元素形成的化合物是重要的半导体材料,应用最广泛的是砷化镓(GaAs),回答下列问题:
(1)基态Ga原子的核外电子排布式为_____,基态As原子核外有_________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1984.5、2961.8、6192由此可推知镓的主要化合价为____和+3。砷的电负性比镍____(填“大”或“小”)。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:________________________。
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000℃,可能的原因是___________________________________________。
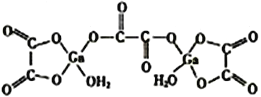
(4)二水合草酸镓的结构如图所示,其中镓原子的配位数为______,草酸根中碳原子的杂化方式为______________。
(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm。该晶体的类型为_________,晶体的密度为___________(设NA为阿伏加德罗常数的数值,列出算式即可)g·cm-3。
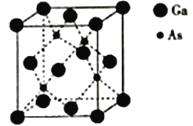
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com