
科目: 来源: 题型:
【题目】1,4-环乙二醇可通过下列路线合成(某些反应的反应物和反应条件未列出):
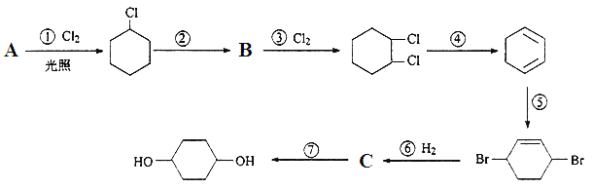
1,4-环乙二醇
(1)A的结构简式是___________________________。
(2)反应②应所需的试剂和条件是_______________________________。
(3)写出反应④、⑦的化学方程式:
④____________________________________________;
⑦_________________________________________。
(4)①的反应类型是_________,②的反应类型是_________,上述七个反应中属于加成反应的有_________(填反应序号),
(5)反应⑤中可能产生一定量的有机副产物,其可能的结构简式为________________________。(写出一种即可)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+。现将硫酸酸化的K2Cr2O7溶液与FeSO4 溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是
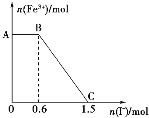
A. 图中AB段的氧化剂为K2Cr2O7
B. 图中BC段发生的反应为2Fe3++2I-=2Fe2++I2
C. 若将上述过程中的KI溶液换为K3[Fe(CN)6]溶液,则AB段有蓝色沉淀生成
D. 开始加入的K2Cr2O7为0.25 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 0.1 mol Fe在0.1 mol氯气中充分燃烧时转移的电子数为0.3NA
B. 0.1 mol乙烷和丙烯的混合物所含氢原子数目为0.6NA
C. 64 g的SO2与足量的O2充分反应后可得到NA个SO3分子
D. 标准状况下,2.24 L四氯化碳含有的分子数目为0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】2015年10月,屠呦呦因发现青蒿素治疗疟疾的新疗法而获得诺贝尔生理学或医学奖。青蒿素分子式C15H22O5,相对分子质量为282.下面关于青蒿素的说法正确的是
A.1 mol C15H22O5的质量为282 g/mol
B.C15H22O5的摩尔质量等于它的相对分子质量
C.一个C15H22O5微粒的质量约为 ![]() g
g
D.含有6.02×1023个碳原子的C15H22O5的物质的量为1 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】溴乙烷是卤代烃的代表,通过对溴乙烷的探究来掌握卤代烃的性质,可以达到举一反三、触类旁通的效果。
I.已知:NaBr+H2SO4(浓) ![]() NaHSO4+ HBr CH3CH2OH+HBr
NaHSO4+ HBr CH3CH2OH+HBr ![]() CH3CH2Br+H2O
CH3CH2Br+H2O
溴乙烷的沸点38.4℃,实验室制备溴乙烷(CH3CH2Br)的装置和步骤如下:
①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;
②在圆底烧瓶中加入10mL95%乙醇、28mL78%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;
③小心加热,使其充分反应。
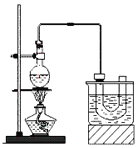
回答下列问题:
(1)为了更好的控制反应温度,除用图示的小火加热,更好的加热方式是_______________。
(2)浓硫酸具有强氧化性,能氧化还原性气体HBr为Br2,导致U形管中粗制的溴乙烷呈棕黄色。为了除去粗产品中的杂质Br2,可选择下列试剂中的:______(填序号)
A.NaOH溶液 B.H2O
C.Na2SO3溶液 D.CCl4
分离时所需的主要玻璃仪器是______________(填仪器名称)。要进一步制得纯净的溴乙烷,可用水洗,然后加入无水CaCl2,再进行_________(填操作名称)。
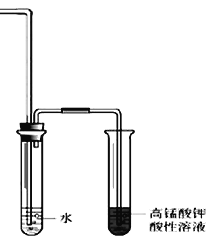
II.溴乙烷在不同溶剂中与NaOH可发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。
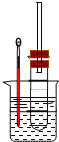
(1)在试管中加入5 mL 1 mol/L NaOH水溶液和5 mL 溴乙烷,将试管如图固定后,加热。
①试管口安装一长导管的作用是_____________________________。
②鉴定生成物中乙醇的结构,可用的波谱是___________________和___________________。
(2)在试管中加入5 mL NaOH乙醇溶液和5 mL 溴乙烷,将试管如图固定后,加热。
①请写出该反应的化学方程式____________________________________________________。
②为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在设计的实验方案中,需要检验的是___________,检验的装置如图所示,在气体通入酸性高锰酸钾溶液前加一个盛水的试管,其作用是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】以铬铁矿(含FeO·Cr2O3、Al2O3、SiO2等)为原料制备二草酸铬钾的实验步骤如图:

回答下列问题:
(1)“熔融”的装置如图,坩埚W的材质可以是___(填“铁”“陶瓷”或“玻璃”);FeO·Cr2O3与KClO3及Na2CO3发生反应,生成Fe2O3、KCl、Na2CrO4和CO2的化学方程式为____。

(2)熔融后的固体中含Na2CrO4、Fe2O3、Na2SiO3、NaAlO2、KCl及NaFeO2等,步骤①的具体步骤为水浸,过滤,调pH为7~8,加热煮沸半小时,趁热过滤。第一次过滤滤渣中的主要成分为_____。
(3)步骤②需加入酸,则加入稀硫酸时发生反应的离子方程式为____。
(4)由步骤③可知,溶解度:Na2Cr2O7____(填“>”“<”或“══”)K2Cr2O7。
(5)步骤④包含的具体操作有___、___过滤并洗涤,经干燥得到K2Cr2O7晶体。(有关物质的溶解度曲线如图所示)

(6)步骤⑤需往两种固体混合物中加入一滴水及少量酒精研磨,所用的硅酸盐质仪器的名称是____。
(7)采用热重分析法测定K[Cr(C2O4)2]·nH2O样品所含结晶水数,将样品加热到80°C时,失掉全部结晶水,失重16.8%。K[Cr(C2O4)2]·nH2O晶体中n=____。
查看答案和解析>>
科目: 来源: 题型:
【题目】某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢.
(1)A的结构简式为_______________________。
(2)A中肯定共面的碳原子数有__个。
(3)若0.1 mol的烃A完全燃烧后,燃烧时消耗标准状况下的氧气____L。
(4)A在催化剂加热条件下发生加聚反应,化学方程式为_______________________________。
(5)在催化剂作用下,与H2加成后的产物名称为_____________________________。
查看答案和解析>>
科目: 来源: 题型:
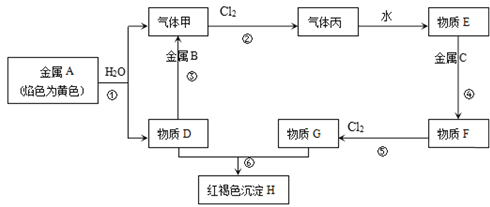
【题目】现有金属单质A、B、C和气体甲、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应条件没有标出)。
请回答下列问题:
(1)写出下列物质的化学式:B___、丙____;
(2)写出下列反应的离子方程式:
反应③_____;
反应⑤_____;
(3)向F的溶液中加入D溶液后产生的现象是____,用化学反应方程式解释产生此现象的原因____、___。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室需要0.1mol·L-1NaOH溶液450mL和0.5mol·L-1硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题:
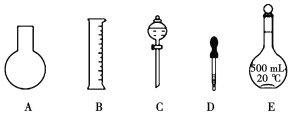
(1)如图所示的仪器中配制溶液肯定不需要的是__________(填序号),配制上述溶液还需用到的玻璃仪器是__________(填仪器名称)。
(2)配制0.1mol·L-1NaOH溶液操作步骤如下:
①把称量好的NaOH`固体放入小烧杯中,加适量蒸馏水溶解;
②把①所得溶液冷却至室温,再小心转入一定容积的容量瓶中;
③继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切;
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;
⑤将容量瓶瓶塞塞紧,充分摇匀。
操作步骤的正确顺序为__________(填序号)。
(3)根据计算用托盘天平称取NaOH的质量为__________g。在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,则所得溶液浓度______________0.10mol·L-1(填“大于”“等于”或“小于”,下同)。若还未等溶液冷却就定容了,则所得溶液浓度__________0.10mol·L-1。
(4)根据计算得知,所需质量分数为98%、密度为1.84g·cm-3的浓硫酸的体积为__________mL(计算结果保留一位小数)。如果实验室有10mL、15mL、20mL、50mL的量筒,应选用__________mL的量筒最好。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)相对分子质量为86的烷烃的分子式是 _________。
(2)用系统命名法命名: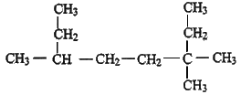 _______________________。
_______________________。
(3)用系统命名法命名: 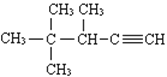 ______________________________。
______________________________。
(4)顺-2-丁烯的结构简式为_________________________。
(5)碳原子数1-10的烷烃中一氯代物只有一种的烷烃有4种,它们的结构简式为CH4、CH3CH3、_____________________、_____________________。
(6)实验室制取乙炔的化学方程式为_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com