
科目: 来源: 题型:
【题目】实验室需要0.1mol/LNaOH溶液450ml和0.5mol/L硫酸溶液500ml。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中,配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
(2)配制0.1mol/L的NaOH溶液的操作步骤如下,正确的顺序是_______。
①把称量好的NaOH固体放入小烧杯中,加适量的蒸馏水溶解;
②用少量蒸馏水洗涤烧杯和玻璃棒2~ 3次,每次洗涤的液体都小心转入容量瓶中,并轻轻摇匀;
③继续向容量瓶中加蒸馏水至液面距刻度线1~ 2cm处,改用胶头滴管小心滴加蒸馏水至溶液的凹液面与刻度线相切;
④把①所得溶液冷却至室温,再小心转入一定容积的容量瓶中;
⑤将容量瓶瓶塞塞紧,充分摇匀。
(3)根据计算,用托盘天平称取NaOH的质量为________g。在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,则所得溶液浓度________0.1mol/L(填“大于”“小于”或“等于”,下同)。若还未等溶液冷却就定容,则所得溶液浓度________0.1mol/L。配制好后,发现称量时所用的托盘天平的砝码生锈了________0.1mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】某盐酸试剂瓶上的标签如图所示。下列有关说法正确的是(设NA表示阿伏加德罗常数的值( )
盐酸
分析纯(AR)
体积:500ml
化学式:HCl
相对分子质量:36.5
质量分数:36.5%
密度:1.19g.ml-1
A.该浓度的盐酸可用广口瓶盛装
B.该盐酸的物质的量浓度为1.19g.ml-1
C.用该盐酸配制250ml2.0mol/L的稀盐酸时需选用100ml的量筒
D.该盐酸中所含Cl-的数目为5.95NA
查看答案和解析>>
科目: 来源: 题型:
【题目】试管是化学实验中最常用的玻璃仪器,对试管加热时,下列操作正确的是( )
A.试管外壁有水珠不一定要擦干,加热时会自然挥发
B.应握紧试管夹,大拇指按在短柄上
C.试管中液体的量不能超过试管容积的1/3
D.可以使试管的受热部位在火焰上方先上下移动,后集中加热
查看答案和解析>>
科目: 来源: 题型:
【题目】图a是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,图b是反应中的CO和NO的浓度随时间变化的示意图。根据图意回答下列问题:
a 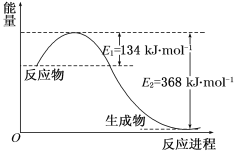 b
b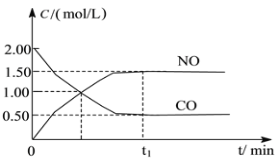
(1)写出NO2和CO反应的热化学方程式_______________。
(2)从反应开始到平衡,用NO2浓度变化表示平均反应速率v(NO2)=__________。
(3)此温度下该反应的平衡常数K=_________;温度降低,K________(填“变大”、“变小”或“不变”)
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在3个体积均为1.0L的恒容密闭容器中发生反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。达到平衡时,下列说法正确的是
2SO3(g) ΔH<0。达到平衡时,下列说法正确的是
容器 | 温度/℃ | 物质的起始浓度/mol·L-1 | 物质的平衡浓度/mol·L-1 | ||
c(SO2) | c(O2) | c(SO3) | c(SO3) | ||
Ⅰ | 758 | 0.2 | 0.1 | 0 | 0.044 |
Ⅱ | 758 | 0.1 | 0.05 | 0 | |
Ⅲ | 858 | 0.2 | 0.1 | 0 | |
A. 从开始至平衡时,容器Ⅰ中SO3的反应速率为0.044 mol·L-1·s-1
B. 平衡时,容器Ⅱ中SO3的浓度小于0.022mol·L-1
C. 平衡时,容器Ⅲ中SO3的浓度大于0.044mol·L-1
D. 若起始时,向容器Ⅰ中充入0.02mol SO2、0.01mol O2和0.02mol SO3,则反应向逆反应方向进行
查看答案和解析>>
科目: 来源: 题型:
【题目】NaC1O2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:

(1)写出“反应”步骤中生成ClO2的化学方程式:______________。
(2) “电解”中阴极反应的主要产物是_______________________。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分別为______________溶液、______________溶液(填化学式)。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。写出“尾气吸收”的离子方程式:_______________________。此吸收反应中,氧化剂与还原剂的物质的量之比为________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为____g(计算结果保留两位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随![]() 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( )
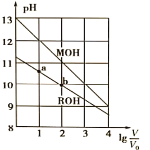
A. MOH的碱性强于ROH的碱性
B. ROH的电离程度:b点大于a点
C. 若两溶液无限稀释,则它们的c(OH-)相等
D. 当![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则![]() 增大
增大
查看答案和解析>>
科目: 来源: 题型:
【题目】SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
(1)SCR(选择性催化还原)工作原理:
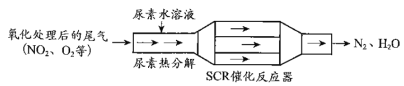
①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式:__________________
②反应器中NH3还原NO2的化学方程式:________________________;
③当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒。用化学方程式表示(NH4)2SO4的形成:_____________________________;
④尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60 g·mol 1)含量的方法如下:取a g尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1 mL c1 mol·L1 H2SO4溶液吸收完全,剩余H2SO4用v2 mL c2 mol·L1 NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是_________________;
(2)NSR(NOx储存还原)工作原理:NOx的储存和还原在不同时段交替进行,如图a所示。
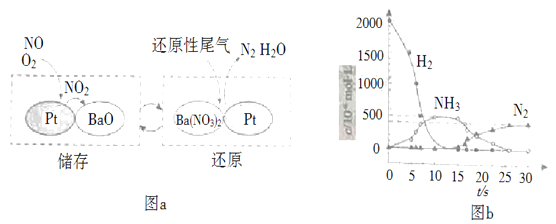
①通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。还原NOx的物质是_________________;
②用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第二步反应消耗的NH3与Ba(NO3)2的物质的量之比是__________________;
③还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整:__________________![]() ____15NNO+___H2O
____15NNO+___H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】砷化镍可用于制作发光器件、半导体激光器、太阳能电池和高速集成电路。
(1)基态Ni原子的价电子排布式为 ___,基态As原子电子占据最高能级的电子云轮廓图为 __ 形。
(2)第一电离能As ___Se(填“>”或“<”) ,原因是____。As2O3(砒霜)是两性氧化物,As2O3溶于盐酸生成AsCl3,AsCl3用LiAlH4还原生成AsH3。
(3)①AlH4-的中心原子的杂化方式为___,其空间构型为____,写出一种与AlH4-互为等电子体的分子的化学式___。
②AsH3分子中H—As—H键角__109.5°(填“>”、“=”或“<”)。AsH3沸点低于NH3,其原因是____。
(4)有机砷![]() 是治疗昏睡病不可缺少的药物,该有机砷中存在的化学键的种类为____(填字母编号)。
是治疗昏睡病不可缺少的药物,该有机砷中存在的化学键的种类为____(填字母编号)。
a.离子键 b.σ键 c.π键 d.碳碳双键
(5)砷化镍激光在医学上用于治疗皮肤及粘膜创面的感染、溃疡等,砷化镍晶胞如图所示,该晶胞密度ρ为____g·cm-3(列式即可,不必化简)。

查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,在体积为10 L的密闭容器中,1 mol A和1 mol B进行反应:2A(g)+B(g)![]() 2C(g),经60 s达到平衡,生成0.6 mol C。下列说法正确的是
2C(g),经60 s达到平衡,生成0.6 mol C。下列说法正确的是
A. 以A浓度变化表示的反应速率为0.001 mol·L-1·s-1
B. 其他条件不变,将容器体积变为5 L,C的平衡浓度变为原来的2倍
C. 其他条件不变,若增大压强,则物质A的转化率减小
D. 达到平衡时,C的体积百分含量为0.353
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com