
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是 ( )
A. AlCl3溶液中滴加过量NH3·H2O:Al3+ + 4OH-= AlO2-+ 2H2O
B. 钠与水的反应:Na+2 H2O =Na++2OH-+H2↑
C. NaHSO4溶液中加BaCl2溶液:SO42-+Ba2+=BaSO4↓
D. 氯气与水的反应:Cl2 + H2O = 2 H+ + ClO-+ Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色溶液。
I.在化学实验和科学研究中,水是一种最常用的溶剂。水是生命之源,它与我们的生活密切相关。(1)写出与H2O分子互为等电子体的微粒:_________(填1种)。
(2)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+ )。下列对上述过程的描述不合理的是____(填字母序号)。
A.氧原子的杂化类型发生了改变 B.微粒子的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
II. Cu2+可形成多种配合物,广泛应用于生产生活中。
(3) 实验时将白色粉末无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配离子。请写出该配离子的化学式 :______。向该蓝色溶液中滴加氨水,先形成难溶物,继续加氨水,难溶物溶解,写出溶解过程的离子方程式:________。溶解后得到深蓝色溶液,向溶液加入乙醇,会析出深蓝色晶体,该晶体的化学式为_________ 。
(4)Cu2+可以与乙二胺(H2N﹣CH2CH2﹣NH2)形成配离子(如图)
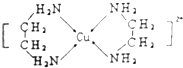
①H、O、N三种元素的电负性从大到小的顺序_______________________.
②乙二胺沸点高于Cl﹣CH2CH2﹣Cl的主要原因是_________________________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐中常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:

提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-,选出a所代表的试剂,按滴加顺序依次为________(只填化学式)。
②分离操作①中所用到的玻璃仪器有____________。
③洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为________。
(2)用提纯的NaCl配制450 mL 4.00 mol·L-1NaCl溶液,所用仪器除药匙、烧杯、玻璃棒外还有________(填仪器名称)。
(3)在实验中多次用到玻璃棒,其作用有三个,分别是______________、______________、______________。
查看答案和解析>>
科目: 来源: 题型:
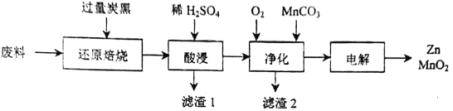
【题目】废旧电池的回收处理,既能减少对环境的污染,又能实现资源的再生利用。将废旧锌锰电池初步处理后,所得废料含MnO2、MnOOH、Zn(OH)2及少量Fe等,用该废料制备Zn和MnO2的一种工艺流程如下:
已知:
①Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化
②有关Ksp数据如下表所示
化合物 | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-13 | 10-17 | 10-38 |
回答下列问题:
(1)还原焙烧过程中, MnOOH与炭黑反应,锰元素被还原为MnO,该反应的化学方程式为___________。传统的工艺是使用浓盐酸在加热条件下直接处理废料,缺点是___________。
(2)酸漫时一般会适当加热并不断搅拌,其作用是___________,滤渣1和滤渣2主要成分的化学式依次是___________。
(3)净化时,先通入O2再加入MnCO3,其目的是___________;已知净化时溶液中Mn2+、Zn2+的浓度约为0.1mol·L-1,调节pH的合理范围是___________。
(4)电解制取MnO2时,MnO2在___________极产生。
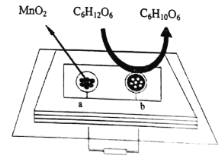
(5)中科院研究人员将MnO2和生物质置于一个由滤纸制成的折纸通道内形成电池,该电池可将软饮料中的葡萄糖作为燃料获得能量,装置如图所示。此装置中b极的电极反应式为______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂,某化学小组的同学在老师的指导下制备氢化钙。
【查阅资料】
Ⅰ、金属Ca的部分性质有:
① 常温或加热条件下Ca都能与氧气反应;;
② Ca常温遇水立即发生剧烈反应生成氢氧化钙和氢气,并放出大量的热;
③ Ca+H2![]() CaH2(固体)
CaH2(固体)
Ⅱ、固体CaH2的部分性质有:
①常温:CaH2+2H2O=Ca(OH)2+2H2↑;②CaH2要密封保存。
【进行实验】
该小组同学设计的制取装置如图所示(固定装置略).

回答下列问题:
(1)写出Ca常温遇水发生反应的化学方程式: 。
(2)B、D中所盛试剂相同,该试剂为 (填名称);D中该试剂的作用是 。
(3)实验时先打开A中活塞,一段时间后,再点燃C中酒精灯,其目的是: 。
【实验反思】
该小组同学通过反思提出问题:上述制得的CaH2是否纯净?
他们再次设计实验进行检验,实验步骤如下:
步骤1:检查装置气密性,装入足量的水和已称好质量为m g的CaH2 样品,按图所示连接仪器(固定装置略)。

步骤2:将Y形管倾斜,使A中的水全部进入B中,样品全部反应后,冷却至室温,读取量筒读数为V mL。
(4)若该实验条件下的气体摩尔体积为Vm L/mol,当V= mL时(用m、Vm表示),表明制得的CaH2样品是纯净的。
查看答案和解析>>
科目: 来源: 题型:
【题目】在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如下图所示。

(1)写出下列线段内发生反应的离子方程式:
OD段_________________________,
CD段_________________________。
(2)原溶液中Mg2+、Al3+的物质的量浓度之比为____________。
(3)图中C点表示当加入_______ mol NaOH时,Al3+已经______,Mg2+已经___________。
(4)图中线段OA∶AB=____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用Na2CO3·10H2O晶体,配制0.2 mol·L-1的Na2CO3溶液480 mL。
(1)应称取Na2CO3·10H2O晶体的质量:___________________。
(2)根据下列操作对所配溶液的浓度产生的影响,完成下列问题:
①Na2CO3·10H2O晶体失去了部分结晶水
②用“左码右物”的称量方法称量晶体(使用游码)
③碳酸钠晶体不纯,其中混有氯化钠
④称量碳酸钠晶体时所用砝码生锈
⑤容量瓶未经干燥使用
其中引起所配溶液浓度偏高的有______________(填序号,下同),偏低的有_____________,无影响的有________________。
(3)下列操作中,容量瓶所不具备的功能有__________(填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.量取一定体积的液体
F.用来加热溶解固体溶质
(4)某同学改用固体Na2CO3配制上述Na2CO3溶液的过程如图所示:


你认为该同学的错误步骤有________(填序号)。
A.1处 B.2处 C.3处 D.4处
查看答案和解析>>
科目: 来源: 题型:
【题目】已知X为Fe2O3和CuO的混合物且氧化性强弱顺序:Fe3+>Cu2+>H+>Fe2+。X样品可发生如图所示的转化关系:
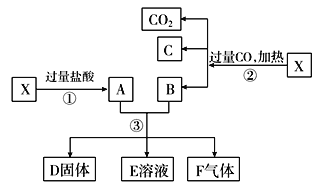
(1)写出步骤③可能发生反应的离子方程式:________________________(共有3个,任写一个即可)。
(2)若溶液E中只有一种金属离子,则一定是__________;若溶液E中含有两种金属离子,则一定是________。
(3)若D固体是纯净物,该固体是________(填化学式)。
(4)印刷电路板是由高分子材料和铜箔复合而成的,可用FeCl3溶液作“腐蚀剂”刻制印刷电路板,该过程发生反应的离子方程式为____________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是( )
A. 氨分子是三角锥形,而甲烷是正四面体形,是因为NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
B. 杂化轨道全部参加形成化学键
C. PCl5分子中P原子和Cl原子最外层都满足8电子结构
D. 在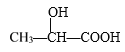 分子中含有2个手性C原子
分子中含有2个手性C原子
查看答案和解析>>
科目: 来源: 题型:
【题目】向X的溶液中,加入Y试剂,产生的沉淀或气体的量如图所示,其中与所述情形相符的是
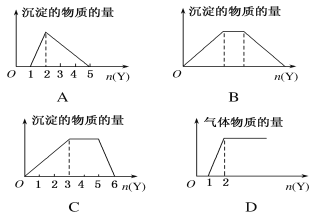
A. 向HCl和AlCl3的混合液中滴加NaOH溶液
B. 向NaOH和Ca(OH)2的混合液中通入CO2
C. 向NH4Al(SO4)2溶液中滴加NaOH溶液
D. 向NaOH和Na2CO3的混合液中滴加稀盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com