
科目: 来源: 题型:
【题目】海洋是资源的宝库,具有十分巨大的开发潜力。工业上从海水提取金属镁的流程如下:
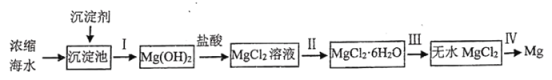
回答下列问题:
(1)沉淀剂是________________(填化学式),不选用同类的其他物质的理由是_______________。
(2)下列选项中,涉及的操作包含操作Ⅰ的是___________。
A 实验室从溴水中提取溴单质
B 除去![]() 固体中的少量NaCl
固体中的少量NaCl
C 从![]() 分解产物中获得
分解产物中获得![]()
D 用工业酒精制无水乙醇
(3)在进行步骤Ⅱ时,如果没有加入盐酸,可能产生的杂质是______________(填化学式)。
(4)一种模拟工业用![]() 制无水
制无水![]() 的实验室设计如下:
的实验室设计如下:
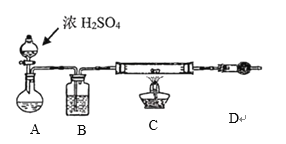
装置A中盛放液体是______________,装置D的作用是____________________________。
(5)步骤Ⅳ发生反应的化学方程式是___________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为____________________;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO________FeO(填“<”或“>”);
(3)NiO晶胞中Ni和O的配位数分别为________、________;
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示。该合金的化学式为________。
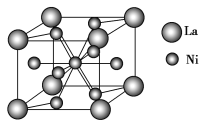
查看答案和解析>>
科目: 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为____________,该元素的符号是________。
(2)Y元素原子的价层电子的轨道表示式为___________,该元素的名称是________。
(3)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是________。
(4)比较X的氢化物与同族第二、三周期元素所形成的氢化物稳定性并说明理由______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在标准状况下,35.5g氯气的体积是___L,将其与氢气完全化合生成氯化氢的物质的量是___mol,将生成的气体制成1L溶液,溶质的物质的量浓度是___mol/L,将此溶液取出20mL加蒸馏水稀释成200mL溶液,此稀稀后的溶液中溶质的物质的量浓度是___mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子的核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
(1)W位于元素周期表第_____周期第____族。W的气态氢化物稳定性比H2O(g)_______(填“强”或“弱”)。
(2)Y的基态原子的核外电子排布式是______, Y的第一电离能比X的________(填“大”或“小”)。
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫铁矿烧渣中含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等,为了充分利用资源,一种利用硫铁矿烧渣制绿矾(
等,为了充分利用资源,一种利用硫铁矿烧渣制绿矾(![]() )的化工流程如下:
)的化工流程如下:
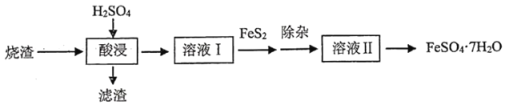
回答下列问题:
(1)酸浸需要使用较浓的硫酸并加热,目的是________________________________,现有![]() ,
,![]() 的硫酸,其物质的量浓度
的硫酸,其物质的量浓度![]() _____________
_____________![]() (保留3位有效数字)。
(保留3位有效数字)。
(2)滤渣除![]() 外,还可能含有__________,溶液Ⅰ需保持
外,还可能含有__________,溶液Ⅰ需保持![]() ,原因是__________。
,原因是__________。
(3)用![]() 还原时,当氧化产物为
还原时,当氧化产物为![]() ,发生主要反应的离子方程式是___________________,检验该反应是否完全发生,所用的试剂是___________________。
,发生主要反应的离子方程式是___________________,检验该反应是否完全发生,所用的试剂是___________________。
(4)除杂时,除去溶液中的![]() ,适宜的物质是_______________。
,适宜的物质是_______________。
A NaOH B H2S C FeS D 氨水
(5)已知![]() ,在不同温度下的溶解度和析出晶体的组成如下表:
,在不同温度下的溶解度和析出晶体的组成如下表:
温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 80 | 90 | |
溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 |
析出晶体 |
|
|
| |||||||
如要获得![]() ,则需对溶液Ⅱ进行的操作是:蒸发浓缩,___________________,过滤,洗涤,干燥。
,则需对溶液Ⅱ进行的操作是:蒸发浓缩,___________________,过滤,洗涤,干燥。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。
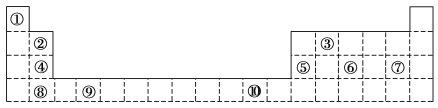
请回答下列问题:
(1)表中属于d区元素的是________(填元素符号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为____;③和⑦形成的一种常见溶剂的化学式为_____。
(3)元素④的第一电离能________元素⑤(选填“>”、“=”或“<”)的第一电离能;元素⑥的电负性________元素⑦(选填“>”、“=”或“<”)的电负性。
(4)元素⑦和⑧形成的化合物的电子式为________________。
(5)某些不同族元素的性质也有一定的相似性,如上表中元素②与元素⑤的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F六种元素的原子序数依次递增。已知:①F的原子序数为29,其余的均为短周期主族元素;②E原子价电子(外围电子)排布为msnmpn-1;③D原子最外层电子数为偶数;④A、C原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)下列叙述正确的是________(填序号)。
A.金属键的强弱:D>E
B.基态原子第一电离能:D>E
C.五种元素中,电负性最大的元素是E
D.晶格能:NaCl<DCl2
(2)F基态原子的核外电子排布式为_____;与F同一周期的副族元素的基态原子中最外层电子数与F原子相同的元素为_____(填元素符号)。
(3)E单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
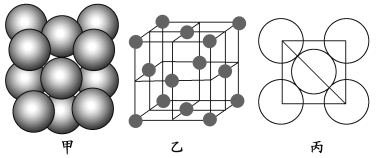
若已知E的原子半径为d,NA代表阿伏加德罗常数,E的相对原子质量为Mr,则一个晶胞中E原子的数目为________,该晶体的密度为_______________ (用字母表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是(NA表示阿伏加德罗常数的值)( )
A.在常温常压下,11.2LN2含有的分子数为0.5NA
B.标准状况下,11.2LH2O含有的分子数为0.5NA
C.在常温常压下,71gCl2所含分子数为NA
D.标准状况下,32gO2中含有的分子数为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】有一种蓝色晶体[可表示为MxFey(CN)6],经X射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上。其晶体中阴离子的最小结构单元如下图所示。下列说法正确的是( )。
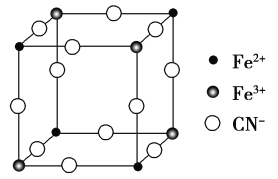
A. 该晶体属于离子晶体,M呈+1价
B. 该晶体属于离子晶体,M呈+2价
C. 该晶体属于分子晶体,化学式为MFe2(CN)6
D. 晶体中与每个Fe3+距离最近且等距离的CN-有12个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com