
科目: 来源: 题型:
【题目】根据下列试题给予的信息,回答问题。
(1)某烃是一种常用的化工原料,可用于制造炸药、农药、苯甲酸、染料、合成树脂及涤纶等。如图是该烃分子的球棍模型,则该烃的分子式是________,其一氯代物有________种。

(2)烯烃与溴化氢、水加成时,产物有主次之分,例如:CH2===CHCH3+HBr―→CH3CHBrCH3(主要产物)+CH3CH2CH2Br(次要产物)
A是一种不对称烯烃,与HBr加成时,生成的主要产物为B,与水加成时,生成的主要产物为C,且B中仅含有4个碳原子、1个溴原子、1种氢原子,则B的结构简式为______________,A的结构简式为______________,A与水在催化剂存在下发生加成反应的化学方程式为________________(只写主要产物)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某样品主要含KCl和少量MgCl2、CaCl2、MgSO4等,需要分离提纯得到KCl。
(1)实验室采用沉淀法测定样品中MgSO4的质量分数。操作步骤如下:
①取10g样品溶于水中,加入足量的BaCl2溶液,充分搅拌反应;②将所得混合物过滤、洗涤。③将沉淀连同滤纸取出放入坩埚中灼烧至恒重(滤纸完全转化成CO2和水,沉淀不分解)④冷却后称量所得沉淀质量为0.466g。
判断沉淀是否洗涤干净的方法是_______________;样品中MgSO4的质量分数为________。
(2)现有几种试剂:①盐酸;②K2CO3;③Na2CO3;④NaOH;⑤KOH;⑥Ba(OH)2;⑦BaCl2;为有效除去样品中的杂质,加入的试剂及顺序合理的是____________,
A.⑦③④ B.⑦⑤② C.②⑥ D.⑤②⑦
过滤除去沉淀后还需要加入的试剂为_________ (填序号),然后进行蒸发结晶。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化氯(ClO2)是一种优良的消毒剂,熔点为-59 ℃,沸点为 11 ℃,浓度过高时易发生分解,甚至爆炸。二氧化氯具有强刺激性和腐蚀性。某课外兴趣小组通过氯气与 NaClO2溶液反应来制取少量ClO2,装置如图所示:
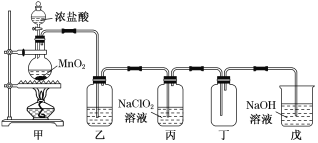
(1)甲装置中圆底烧瓶内发生反应的化学方程式是______________________________________。
(2)Cl-存在时会催化 ClO2的生成,若无乙装置,则丙装置内产生 ClO2的速率明显加快。乙装置中试剂瓶内的液体是__________。实验过程中常需通入适量的 N2稀释 ClO2,其目的是_____________________________________________。
(3)丙装置中发生的反应为:Cl2+2NaClO2===2ClO2↑+2NaCl 。
下列有关该实验的说法正确的是________________
A. 可用微热法检查实验装置的气密性
B. 如果乙装置是盛有浓硫酸,更有利于实验安全
C. 若甲中足量MnO2与含0.4 molHCl的浓盐酸反应,则丙中可制得0.2molClO2
D. 实验过程甲装置要缓缓加热,不宜强热
(4)戊装置烧杯中NaOH 溶液,其作用是_________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】四氯化钛(TiCl4)是制取航空材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3,不溶于水)制备TiCl4等产品的一种工艺流程示意如图:
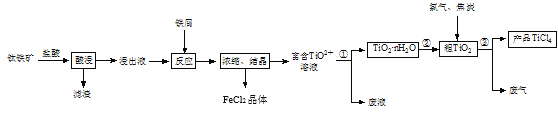
回答下列问题:
(1)“酸浸”时需要将钛铁矿粉碎,其目的是____。
(2)浸出液呈强酸性,含有TiO2+、Fe2+及少量Fe3+、Al3+等离子,则生成TiO2+的离子方程式是__。
(3)“反应”时需加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe=3Fe2+
2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
加入铁屑的作用是____。
(4)通过控制条件,可以使过程①中生成的TiO2·nH2O形成一种液态分散系,用一束光照射该分散系能够产生丁达尔效应,则分散质颗粒直径的范围是____。
(5)过程①制得的固体TiO2·nH2O需用过量酸清洗以除去其中的Fe(OH)3杂质,检验Fe(OH)3杂质除净的实验方法是____。
(6)过程③生成的废气中含有CO,则TiO2和焦炭、氯气在高温下发生反应的化学方程式是___。
(7)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是____(只要求写出一项)。
(8)依据表中信息,可采用___方法精制含少量SiCl4杂质的TiCl4。
TiCl4 | SiCl4 | |
熔点/℃ | -25.0 | -68.8 |
沸点/℃ | 136.4 | 57.6 |
查看答案和解析>>
科目: 来源: 题型:
【题目】从溴乙烷制取1, 2-二溴乙烷,下列转化方案中最好的是
A. CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH2=CH2
CH2=CH2![]() CH2BrCH2Br
CH2BrCH2Br
B. CH3CH2Br![]() CH2BrCH2Br
CH2BrCH2Br
C. CH3CH2Br![]() CH2=CH2
CH2=CH2![]() CH2BrCH3
CH2BrCH3![]() CH2BrCH2Br
CH2BrCH2Br
D. CH3CH2Br![]() CH2=CH2
CH2=CH2![]() CH2BrCH2Br
CH2BrCH2Br
查看答案和解析>>
科目: 来源: 题型:
【题目】通过膜电池可除去废水中的乙酸钠和对氯苯酚(![]() ),其原理如图所示,下列说法错误的是
),其原理如图所示,下列说法错误的是
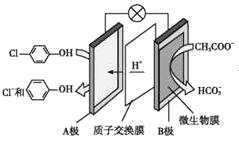
A.该方法能够提供电能
B.B极上的电势比A极上的电势低
C.A极的电极反应为![]() +H++2e-→Cl-+
+H++2e-→Cl-+![]()
D.电池工作时H+通过质子交换膜由正极区向负极区移动
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下列反应曾用于检测司机是否酒后驾驶:2![]() +3CH3CH2OH+16H++13H2O
+3CH3CH2OH+16H++13H2O![]() 4[Cr(H2O)6]3++3CH3COOH
4[Cr(H2O)6]3++3CH3COOH
①配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是___(填元素符号)。
②CH3COOH中C原子轨道杂化类型为___;1 mol CH3COOH分子含有σ键的数目为___。
(2)CS2分子中,C原子的杂化轨道类型是____,写出两个与CS2具有相同空间构型和键合形式的离子____。
(3)石墨烯是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯。
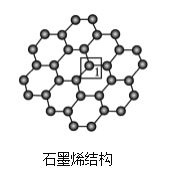
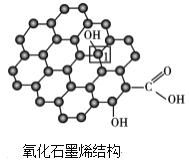
氧化石墨烯中,1号C的杂化方式是____,该C与相邻C形成的C-C键角____(填“>”、“<”或“=”)石墨烯中与1号C相邻C形成的C-C键角。
查看答案和解析>>
科目: 来源: 题型:
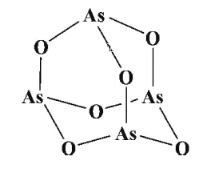
【题目】砷(As)元素及其化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)基态As原子的核外电子排布式为_____,砷与硒的第一电离能较大的是_____。
(2)传统中药的砷剂俗称“砒霜”,其分子结构如图所示,该化合物中As、O原子的杂化方式分别为____、_____。
(3)Na3AsO4可作杀虫剂。![]() 的立体构型为____,与其互为等电子体的分子的化学式为_____(任写一种)。
的立体构型为____,与其互为等电子体的分子的化学式为_____(任写一种)。
(4)H3AsO4和H3AsO3是砷的两种含氧酸,请根据物质结构与性质的关系,解释H3AsO4比H3AsO3酸性强的原因_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学实验室需要1.500 mol·L-1硫酸溶液450 mL。根据溶液的配制情况回答下列问题:
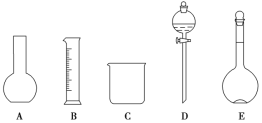
(1)如图所示的仪器中配制溶液肯定不需要的是______(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
(2)现用质量分数为98%、密度为1.84 g·cm-3的浓硫酸来配制450 mL 1.50 mol·L-1的稀硫酸。计算所需浓硫酸的体积为________ mL (保留1位小数),现有 ①10 mL ②25 mL ③50 mL ④100 mL四种规格的量筒,最好选用的量筒是________(填代号)。
(3)配制时,一般可分为以下几个步骤:
①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为:②→①→③→___→_____→_____→______→④(填序号)。
(4)在配制过程中,下列操作中会导致所配制的溶液浓度偏高的有________。
①用量筒量取浓硫酸时候,俯视刻度线
②洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④定容时,俯视刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】根据杂化轨道理论和价电子对互斥模型判断,下列分子或者离子的中心原子杂化方式及空间构型正确的是( )
选项 | 分子或离子 | 中心原子杂化方式 | 价电子对互斥模型 | 分子或离子的立体构型 |
A. | SO2 | sp | 直线形 | 直线形 |
B. | HCHO | sp2 | 平面三角形 | 三角锥形 |
C. | NF3 | sp2 | 四面体形 | 平面三角形 |
D. |
| sp3 | 正四面体形 | 正四面体形 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com