
科目: 来源: 题型:
【题目】我国政府为消除碘缺乏病,规定在食盐中必须加入适量的碘酸钾,现实验室需要配制480mL 0.1mol/LKIO3溶液,实际操作步骤有:
(1)需称量碘酸钾的质量为___g。
(2)配制溶液时下列仪器中:
A.锥形瓶 B.托盘天平 C.烧杯 D.胶头滴管 E.药匙 F.量筒
不需要用到的是__(填序号),尚缺的玻璃仪器有___和___(写名称)。
(3)人们常将配制过程简述为以下各步骤:
A.冷却 B.称量 C.洗涤 D.定容 E.溶解 F.摇匀 G.转移 H.装入试剂瓶
其正确的操作顺序应是___(填序号)。
①B E A G C G D F H ②B E G A C G F D H
③B E F G C G D H A ④B E A G C G D H F
(4)在此配制过程中,下列情况会使配制结果偏高的是____ (填序号)。
①转移时未洗涤烧杯和玻璃棒 ②定容时俯视刻度线观察液面
③定容时仰视刻度线观察液面 ④容量瓶用蒸馏水洗干净后未干燥
⑤摇匀后静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(5)检验食盐中是否加碘,可利用如下反应:KIO3+KI+H2SO4─ K2SO4+I2+H2O(未配平)
①配平该方程式,并且用双线桥法表示该方程式电子转移的方向和数目:___。
②该反应中氧化剂和还原剂的物质的量之比为___。
③如果反应中转移0.5mol电子,则生成I2的物质的量为____mol
查看答案和解析>>
科目: 来源: 题型:
【题目】把1L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含0.2 molNaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含0.5molBaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
A.0.3mol·L-1B.1.6mol·L-1
C.0.6mol·L-1D.0.8mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】肌红蛋白(Mb)可与O2结合生成MbO2:![]() 。37℃时测得肌红蛋白的结合度(α)与p(O2)的关系如下表。
。37℃时测得肌红蛋白的结合度(α)与p(O2)的关系如下表。
已知:K=![]()
[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的物质的量分数]
p(O2)/kPa | 0.50 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 |
α(MbO2)% | 50.0 | 66.7 | 80.0 | 85.7 | 88.9 | 90.9 | 92.3 |
(1) 37℃时,若空气中氧气分压为21.0 kPa,则人正常呼吸时α的最大值为________%(保留1位小数)。
(2) 温度不变时,游客在山顶时体内MbO2的浓度比在山下________(填“高”或“低”)。
(3) 研究发现,v正=k正·c(Mb)·p(O2),v逆=k逆·c(MbO2)。已知37℃时k逆=60 s-1,则k正=_________(注明速率常数单位)。
查看答案和解析>>
科目: 来源: 题型:
【题目】二甲醚(CH3OCH3)被称为21世纪的新型能源,它清洁、高效、具有优良的环保性能。
Ⅰ.工业制备二甲醚的生产流程如下:

催化反应室中(压强2.0~10.0 MPa,温度230~280℃)进行下列反应:
CO(g)+2H2(g)![]() CH3OH(g) ΔH=-90.7 kJ/mol ①
CH3OH(g) ΔH=-90.7 kJ/mol ①
2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol ②
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol ②
CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=-41.2 kJ/mol ③
CO2(g)+H2(g) ΔH=-41.2 kJ/mol ③
(1)甲烷氧化可制得合成气,反应如下:CH4(g)+![]() O2(g)
O2(g)![]() CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是____________反应(填“自发”或“非自发”)。
CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是____________反应(填“自发”或“非自发”)。
(2)催化反应室中总反应3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g)的ΔH= _____________。该反应的平衡常数表达式为:_______;在830℃时K=1.0,则在催化反应室中该反应的K______1.0(填“>”、“<”或“=”)。
CH3OCH3(g)+CO2(g)的ΔH= _____________。该反应的平衡常数表达式为:_______;在830℃时K=1.0,则在催化反应室中该反应的K______1.0(填“>”、“<”或“=”)。
(3)上述反应中,可以循环使用的物质有__________。
Ⅱ.如图为绿色电源“二甲醚燃料电池”的工作原理示意图。
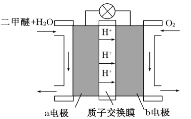
a电极是________极,其电极反应方程式为_________________。
查看答案和解析>>
科目: 来源: 题型:
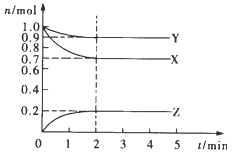
【题目】(1)某温度时,在2 L容器中X、Y、Z三种气态物质的量随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式为_________。反应开始至2 min,Z的平均反应速率为__________。
(2)甲烷作为能源燃烧放出大量的热,已知:
①2CH4(g)+3O2(g)=2CO(g)+4H2O(l) △H1= -1214 kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2=-566 kJ/mol
则表示甲烷燃烧热的热化学方程式___________________________________________。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成_________沉淀(填化学式),生成该沉淀的离子方程式为__________________(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)。
(4)Na2S溶液具有较强的碱性,其原因为______________________。(用离子方程式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,将1.000 mol/L盐酸滴入20.00 mL1.000mol/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是

A. a点由水电离出的c(H+)=1.0×10-14 mol/L
B. b点:c(NH4+)+c(NH3·H2O)=c(Cl-)
C. c点:c(Cl-)=c(NH4+)
D. d点前,溶液温度上升的主要原因是NH3·H2O电离放热
查看答案和解析>>
科目: 来源: 题型:
【题目】随着老百姓生活水平的提高,汽车进入寻常百姓家,在发生剧烈的汽车碰撞时,汽车安全气囊会发生反应10NaN3+2KNO3![]() K2O+5Na2O+16N2↑,有关该反应说法正确的是( )
K2O+5Na2O+16N2↑,有关该反应说法正确的是( )
A.氧化剂与还原剂的物质的量之比为5:1B.N2既是氧化产物也是还原产物
C.NaN3是氧化剂D.KNO3发生氧化反应
查看答案和解析>>
科目: 来源: 题型:
【题目】清洁能源的开发、废水的处理都能体现化学学科的应用价值。
Ⅰ. 工业上可利用CO2来制备清洁燃料甲醇,有关化学反应如下:
反应A:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1
反应B:CO2(g)+H2![]() H2O(g)+CO(g) △H2=+41kJ·mol-1
H2O(g)+CO(g) △H2=+41kJ·mol-1
(1)写出用CO(g)和H2(g)合成CH3OH(g)反应的热化学方程式: _____________________________。
(2)写出两个有利于提高反应A中甲醇平衡产率的条件_______________________。
(3)在Cu-ZnO/ZrO2催化下,CO2和H2混和气体,体积比1∶3,总物质的量amol进行反应,测得CO2转化率、CH3OH和CO选择性随温度、压强变化情况分别如图所示(选择性:转化的CO2中生成CH3OH或CO的百分比)。

温度对反应的影响 压强对反应的影响
由以上两图可知,影响产物选择性的外界条件是______。
A. 温度 B. 压强 C. 催化剂
Ⅱ.实验室模拟“间接电化学氧化法”处理氨氮废水中NH4+的装置如图所示。以硫酸铵和去离子水配制成初始的模拟废水,并以NaCl调节溶液中氯离子浓度,阳极产物将氨氮废水中的NH4+氧化成空气中的主要成分。

(4)阳极反应式为__________________________________。
(5)除去NH4+的离子反应方程式为________________________________________。
Ⅲ.电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO3-的原理如图所示:

(6)A为_______极,若电解过程中转移1 mol 电子,则膜来两侧电解质溶液的质量变化差(Δm左 -Δm右)为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化硫的催化氧化是工业上生产硫酸的主要反应,反应如下:2SO2(g)+O2(g)![]() 2SO3(g) △H1=-197.7kJ·mol-1 K1(浓度平衡常数)
2SO3(g) △H1=-197.7kJ·mol-1 K1(浓度平衡常数)
为研究该反应,某同学设计了以下三种已装固体V2O3催化剂的密闭容器装置

(1)在初始体积与温度相同的条件下,甲、乙、丙中均按2 mol SO2、1molO2投料,达平衡时,三个容器中SO2的转化率从大到小的顺序为___________________(用“甲、乙、丙”表示)。
(2)在容器丙中,0.1MPa条件下,在不同温度或不同投料方式下研究上述反应得到数据如下表:
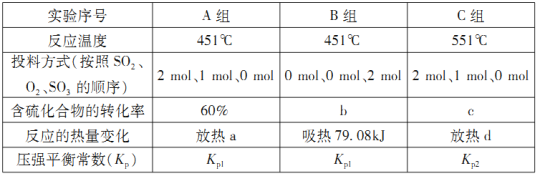
①表中:a=___________;b=___________。
②已知用平衡分压(分压=总压×物质的量分数)代替平衡浓度计算,得到的平衡常数即为压强平衡常数,则Kp1___________Kp2(填“>”、“<”或“=”)。
③451℃,若按0.4 mol SO2、0.4molO2、0.4 mol SO3进行投料,则反应开始时v正(SO2)_______v逆(SO2)(填“>”、“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是

A. a 和 b 不连接时,铁片上会有金属铜析出
B. 无论 a 和 b 是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
C. a 和 b 分别连接直流电源正、负极,铜片上发生的反应为:Cu-2e-=Cu2+
D. a 和 b 分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com