
科目: 来源: 题型:
【题目】2018年11月4日凌晨,福建泉州泉港区发生“碳九”泄露,对海洋环境造成污染,危害人类健康。“碳九”芳烃主要成分包含![]() (a)、
(a)、![]() (b)、
(b)、![]() (c)等,下列有关三种上述物质说法错误的是
(c)等,下列有关三种上述物质说法错误的是
A. a、b、c互为同分异构体 B. a、b、c均能与酸性高锰酸钾溶液反应
C. a中所有碳原子处于同一平面 D. 1molb最多能与4molH2发生反应
查看答案和解析>>
科目: 来源: 题型:
【题目】氮(N)、磷(P)、砷(As)等ⅤA元素化合物在研究和生产中有重要用途。如我国科研人员研究发现As2O3或写成As4O6,俗称砒霜)对白血病有明显的治疗作用。回答下列问题:
(1)As原子的简化的核外电子排布式为_____;P的第一电离能比S大的原因为________。
(2)写出一种与CN-互为等电子体的分子___(用化学式表示);(SCN)2分子中σ键和π键个数比为__。
(3)砒霜剧毒,可用石灰消毒生成AsO33-少量AsO43-,其中AsO33-中As的杂化方式为___,AsO43-的空间构型为___。
(4)NH4+中H-N-H键角比NH3中H-N-H的键角大的原因是____;NH3和水分子与铜离子形成的化合物中阳离子呈轴向狭长的八面体结构(如图Ⅰ),该化合物加热时首先失去水,请从原子结构角度加以____。
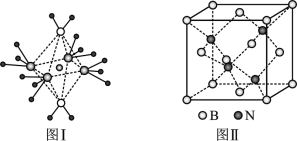
(5)BN的熔点为3000℃,密度为2.25g/cm3,其晶胞结构如上图Ⅱ所示,晶体中一个B原子周围距离最近的N原子有____个;若原子半径分别为rN和rB,阿伏加德罗常数值为NA,则BN晶胞中原子的体积占晶胞体积的百分率为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】有色金属行业发展蕴藏着巨大潜力。目前,全世界消费量排在前五位为铜、铝、铅、锌、镍。
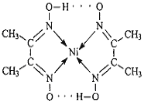
(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于___晶体;基态Ni原子的价电子电子排布式为____。
(2)铜原子的电子占有____种能量不同的原子轨道。
(3)配合物分子内(如图)的作用力有_____(填编号)。
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(4)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如 ①CH2=CH2、②CH≡CH、③![]() 、④HCHO等,其中分子中C原子为SP2杂化的有____(填物质序号),预测HCHO分子的立体结构为_____形。
、④HCHO等,其中分子中C原子为SP2杂化的有____(填物质序号),预测HCHO分子的立体结构为_____形。
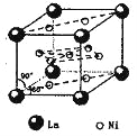
(5)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。该合金的晶胞如右图所示,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上。该晶体的化学式为______。
(6)邻羟基苯甲醛的沸点____(填大于,小于或等于)对羟基苯甲醛的沸点。
查看答案和解析>>
科目: 来源: 题型:
【题目】铍及其化合物的应用正日益被重视。
(1)最重要的含铍矿物是绿柱石,含2%铬(Cr)的绿柱石即为祖母绿。基态Cr原子价电子的排布图为_______。
(2)铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的有_____(填字母)。
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液pH均小于7
(3)铍、铝晶体都是由金属原子密置层在三维空间堆积而成(最密堆积)。铍的熔点(1551K)比铝的熔点(930K)高,原因是____。
(4)氯化铍在气态时存在BeCl2分子(a)和二聚分子(BeCl2)2(b),固态时则具有如下图所示的链状结构(c)。
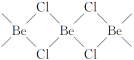
①a属于____(填“极性”或“非极性”)分子。
②二聚分子(BeCl2)2中Be原子的杂化方式相同,且所有原子都在同一平面上。b的结构式为____(标出配位键)。
(5)Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所:
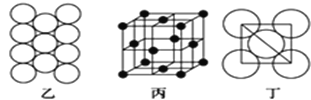
若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为___个;Al晶体的密度为_____(用字母表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为________。
(2)B的氢化物的分子空间构型是_____。其中心原子采取___杂化。
(3)写出化合物AC2的电子式____;一种由B、C组成的化合物与AC2互为等电子体,其化学式为_____。
(4)ECl3与B、C的氢化物形成配位数为六的配合物的化学式为_____
查看答案和解析>>
科目: 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是( )
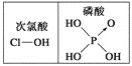
A. SO2易溶于水只是因为相似相溶原理
B. 乳酸(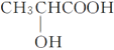 )分子中含有一个手性碳原子
)分子中含有一个手性碳原子
C. 碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”原理解释
D. 由上图知酸性:H3PO4>HClO,因为H3PO4中非羟基氧原子数大于次氯酸中非羟基氧原子数
查看答案和解析>>
科目: 来源: 题型:
【题目】现以淀粉或乙烯为主要原料都可以合成乙酸乙酯,其合成路线如图所示。

(已知:2CH3CHO+O2![]() 2CH3COOH)
2CH3COOH)
(1)A中含有的官能团名称是______________;其中③的反应类型是______________;
⑥的反应类型是______________;
(2)写乙烯的电子式:_________________乙烯的结构简式:____________;
(3)写出下列反应的化学方程式:①__________________;⑤______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】气体A的产量可以用来衡量一个国家石油化工发展水平。下图是由A为原料生产B的转化关系图,B是一种有香味的液体。

(1)将A通入溴水中,观察到的实验现象是__________,A分子中的官能团是______。
(2)写出CH3CH2OH与CH3COOH反应生成B的化学方程式_____________________。
(3)写出乙醇的一种用途____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在20世纪90年代末期,科学家发现并证明碳有新的单质形态C60存在。后来人们又相继得到了C70、C76、C90、C94等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家庭。下列有关说法错误的是( )
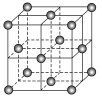
A. 金刚石、C60、C70、管状碳和洋葱状碳都不能与H2发生加成反应
B. 已知C(石墨,s)===C(金刚石,s) ΔH>0,则石墨比金刚石稳定
C. C60晶体结构如图所示,每个C60分子周围与它最近且等距离的C60分子有12个
D. 熔点比较:C60<C70<C90<金刚石
查看答案和解析>>
科目: 来源: 题型:
【题目】非物质文化遗产“芜湖铁画”的某些产品中含有铁、金和碳等成分(其他成分忽略不计)。某同学取一定质量的铁画废弃样品,加入100mL稀盐酸中,恰好完全反应,放出0.3gH2,剩余固体质量为0.1g。请计算:
(1)样品中铁的质量分数。
(2)稀盐酸的物质的量浓度。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com