
科目: 来源: 题型:
【题目】下列各组物质之间通过一步反应能实现如图所示转化关系,且与表中条件也匹配的是( )
选项 | X | Y | Z | 箭头上为反应条件或试剂 |
|
A | Fe | FeCl2 | FeCl3 | ①通入少量Cl2 | |
B | Na2CO3 | NaCl | NaHCO3 | ②先通CO2,再通过量NH3 | |
C | MgO | MgCl2 | Mg(OH)2 | ③加热 | |
D | NaAlO2 | Al(OH)3 | Al2O3 | ④加水 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】用如右图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )
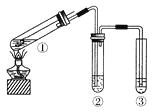
A. 上下移动①中铜丝可控制SO2的量
B. ②中选用品红溶液验证SO2的生成
C. ③中选用NaOH溶液吸收多余的SO2
D. 为确认CuSO4生成,向①中加水,观察颜色
查看答案和解析>>
科目: 来源: 题型:
【题目】为了验证浓硫酸和木炭粉在加热条件下产生的气体产物,某同学选用了如图所示的实验装置。下列说法错误的是
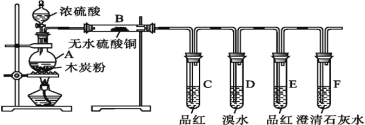
A.B装置用来检验产物中是否有水蒸气生成
B.C装置用来检验产物中是否有SO2生成
C.D装置中溴水褪色,则说明SO2具有漂白性
D.F装置用来检验产物中是否有CO2生成
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)CS2是一种常用的溶剂,CS2的分子中存在___个σ键。在H—S、H—Cl两种共价键中,键的极性较强的是____,键长较长的是____。
(2)SO2与CO2分子的立体结构分别是______和_____,相同条件下两者在水中的溶解度较大的是______(写分子式),理由是________。
(3)醋酸的球棍模型如图1所示。
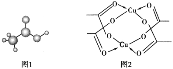
①在醋酸中,碳原子的轨道杂化类型有_____;
②Cu的水合醋酸盐晶体局部结构如图2所示,该晶体中含有的化学键是_____(填选项字母)
A.极性键 B.非极性键 C.配位键 D.金属键
查看答案和解析>>
科目: 来源: 题型:
【题目】自然界中铝元素主要存在于铝土矿(主要成分为Al2O3、FeO、Fe2O3、SiO2)中,铝的单质及其化合物在生产、生活、科研等领域应用广泛。工业上用铝土矿制备铝的某种化合物的工艺流程如下:
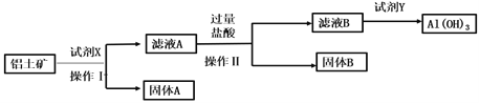
下列说法错误的是( )
A.在实验室实施操作Ⅰ需要的玻璃仪器是漏斗、烧杯、玻璃棒
B.为使铝元素全部转化为Al(OH)3,每一步操作的试剂均需过量
C.将试剂X与操作Ⅱ的试剂过量盐酸互换,也可制得Al(OH)3
D.固体A的主要成分是FeO和Fe2O3
查看答案和解析>>
科目: 来源: 题型:
【题目】现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B元素原子的核外p电子数比s电子数少1个 |
C元素原子的第一至第四电离能分别是:I1=738 kJ·mol-1;I2=1 451 kJ·mol-1;I3=7 733 kJ·mol-1;I4=10 540 kJ·mol-1 |
D原子核外所有p轨道全满或半满 |
E元素的主族序数与周期数的差为4 |
F是前四周期中电负性最小的元素 |
G在周期表的第七列 |
(1)B基态原子中能量最高的电子,其电子云在空间有_____个方向,原子轨道呈___形
(2)某同学根据上述信息,推断C基态原子的核外电子排布图为![]()
![]() 该同学所画的电子排布图违背了____。
该同学所画的电子排布图违背了____。
(3)G位于______族______区,价电子排布式为______。
(4)检验F元素的实验方法是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】针对如图所示的实验室制取氨气,下列说法正确的是
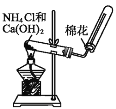
A.发生装置与用 KClO3 制取O2 的装置相同
B.可以用碱石灰或无水氯化钙干燥制得的氨气
C.可用单孔橡皮塞代替棉花
D.所用的铵盐不能是 NH4NO3,所用的碱可以是 NaOH
查看答案和解析>>
科目: 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾。工艺流程如下:回答下列问题:
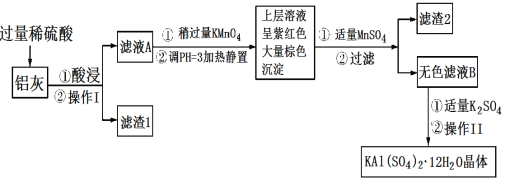
(1)明矾净水的原理是______________(用离子方程式表示)。
(2)操作Ⅰ是________,操作Ⅱ是蒸发浓缩、__________、过滤、洗涤、干燥。
(3)检验滤液A中是否存在Fe2+的试剂是__________(只用一种试剂)。
(4)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是__________,在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4-转化为Mn2+):_______。
(5)已知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:________,滤渣2含有的物质是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com