
科目: 来源: 题型:
【题目】现需设计一套实验装置来电解饱和食盐水,并测量电解产生的氢气的体积(约6 mL)和检验氯气的氧化性(不应将多余的氯气排入空气中)。
(1)试从下图中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是A接__________,B接__________。
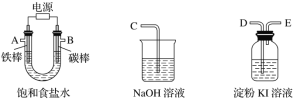
(2)铁棒接直流电源的________极;碳棒上发生的电极反应为_______。
(3)能说明氯气具有氧化性的实验现象是_______________________。
(4)假定装入的食盐水为50 mL,一段时间后,产生5.6 mL(标准状况)H2时,所得溶液在25 ℃时的pH=________。
(5)若将B电极换成铁电极,写出在电解过程中U形管底部出现的现象: __________。
查看答案和解析>>
科目: 来源: 题型:
【题目】图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )
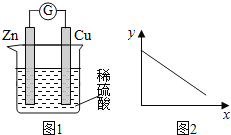
A. 铜棒的质量 B. c(Zn2+) C. c(H+) D. c(SO42-) -
查看答案和解析>>
科目: 来源: 题型:
【题目】可用于电动汽车的铝—空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是( )
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH-
B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-=Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路由正极流向负极
查看答案和解析>>
科目: 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
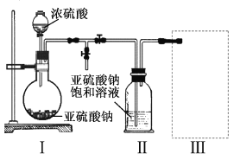
实验一焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置II中有Na2S2O5晶体析出,发生的反应为:
Na2SO3+SO2=Na2S2O5
(1)装置I中产生气体的化学方程式为 。
(2)要从装置II中获得已析出的晶体,可采取的分离方法是 。
(3)装置III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为 。(填序号)。
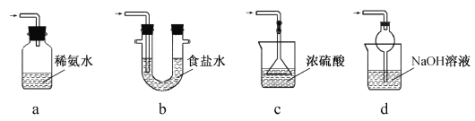
实验二焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)检验Na2S2O5晶体在空气中已被氧化的实验方案是 。
实验三葡萄酒中抗氧化剂残留量的测定
(5)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:馏分中的二氧化硫在滴入碘水时发生的反应为
SO2+I2+2H2O=H2SO4+2HI)在测定时消耗了0.01mol·L-1的I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 g·L-1。在上述实验过程中,若有部分HI被空气氧化,则测得结果 (填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有A、B、C、D、E五种阴阳离子均不相同的化合物,五种阳离子为![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,五种阴离子为
,五种阴离子为![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 现将它们分别配成
现将它们分别配成![]() 的溶液,进行如下实验
的溶液,进行如下实验
![]() 测得溶液A、B呈碱性,且碱性为
测得溶液A、B呈碱性,且碱性为![]() ;
;
![]() 向C溶液中滴加稀盐酸,有气体生成;
向C溶液中滴加稀盐酸,有气体生成;
![]() 向D溶液中滴加NaOH溶液,先岀现沉淀,继续滴加,沉淀消失
向D溶液中滴加NaOH溶液,先岀现沉淀,继续滴加,沉淀消失
请根据上述实验现象,回答下列问题
![]() 实验
实验![]() 中发生反应的化学方程式为______________;向C中滴加NaOH溶液,出现的现象为_________。
中发生反应的化学方程式为______________;向C中滴加NaOH溶液,出现的现象为_________。
![]() 分两步写出实验
分两步写出实验![]() 中发生反应的离子方程式______________。
中发生反应的离子方程式______________。
![]() 写出下列四种化合物的化学式:A______________;B______________。
写出下列四种化合物的化学式:A______________;B______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)系统命名法给下列有机物命名:
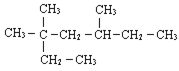 ______
______
(2)某烷烃的相对分子质量为114,该烷烃的化学式为______。
(3)完全燃烧0.2mol某烃,燃烧产物依次通过浓硫酸和碱石灰,实验结束后,称得浓硫酸增重18g,碱石灰增重35.2g。则:
①该烃的化学式__________;
②写出其可能的结构简式:__________
查看答案和解析>>
科目: 来源: 题型:
【题目】根据电化学知识回答下列问题。
Ⅰ、某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾。
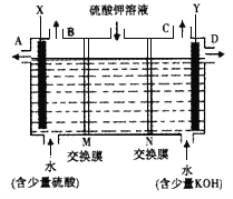
(1)X极与电源的_____(填正或负)极相连,氢气从____ (选填A、 B、C或D)口导出。
(2)离子交换膜只允许一类离子通过,则M为________(填阴离子或阳离子,下同)交换膜,N为________交换膜。
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池正极的电极反应式为___________________
Ⅱ、铅蓄电池是常见的二次电池,其放电反应和充电反应表示如下:Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(l)
2PbSO4(s)+2H2O(l)
写出它放电时正极的电极反应式______________________________________;
充电时阴极的电极反应式______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫及其化合物有许多用途。请回答下列问题。
![]() 基态硫离子价层电子的轨道表达式为____,其电子填充的最高能级的轨道数为____。
基态硫离子价层电子的轨道表达式为____,其电子填充的最高能级的轨道数为____。
![]() 常见含硫的物质有单质硫
常见含硫的物质有单质硫![]() 、
、![]() 、
、![]() 、
、![]() 等,四种物质的熔点由高到低的顺序依次为__________。
等,四种物质的熔点由高到低的顺序依次为__________。
![]() 方铅矿
方铅矿![]() 即硫化铅
即硫化铅![]() 是一种比较常见的矿物,酸溶反应为:
是一种比较常见的矿物,酸溶反应为:![]() 浓
浓![]() ,则
,则![]() 中配位原子是__________,第一电离能
中配位原子是__________,第一电离能![]() __________
__________![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ,
,![]() 中硫的杂化方式为______________,下列气态分子的空间构型与
中硫的杂化方式为______________,下列气态分子的空间构型与![]() 相同的有__________。
相同的有__________。
A.SnCl2 B.SO3 ![]()
![]()
![]() 方铅矿的立方晶胞如图所示,硫离子采取面心立方堆积,铅离子填在由硫离子形成的__________空隙中。已知晶体密度为ρg·cm-3,阿伏加德罗常数的值为
方铅矿的立方晶胞如图所示,硫离子采取面心立方堆积,铅离子填在由硫离子形成的__________空隙中。已知晶体密度为ρg·cm-3,阿伏加德罗常数的值为![]() ,则晶胞中硫离子与铅离子最近的距离为__________nm。
,则晶胞中硫离子与铅离子最近的距离为__________nm。

查看答案和解析>>
科目: 来源: 题型:
【题目】联合国宣布2019年为“国际化学元素周期表年”。短周期主族元素A、B、C、D、E的原子序数依次增大。A原子的最外层电子数是其内层电子数的2倍,B的单质是空气的最主要成分,C的单质在某些浓酸溶液中能发生钝化,D和A在同一主族,E的其中一种氧化物是造成酸雨的主要物质之一。请回答下列问题:
(1)A元素的名称为_________;元素E在周期表中的位置是________。
(2)A、B、D的原子半径的大小顺序是_________(用元素符号表示)。A和D的简单气态氢化物中稳定性较强的是___________(用化学式表示)。
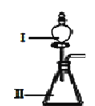
(3)B和D最高价氧化物对应的水化物中,酸性较强的是___________。若用如图中装置验证这两种酸的酸性强弱,则在装置Ⅱ中加入的试剂分别为__________,观察到的实验现象是__________。
(4)AE2常温下呈液态,则AE2的化学键类型是_______。已知AE2在氧气中完全燃烧,生成AO2和EO2,若 0.1 mol AE2在 1 mol O2中完全燃烧,所得混合气体在标准状况下的体积为________L。
(5)B的最高价氧化物对应的水化物的稀溶液与SO2反应的离子方程式为________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com