
科目: 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,m为单质,d是淡黄色粉末,b是生活中常见的液态化合物。上述物质的转化关系如图所示。下列说法正确的是

A. 化合物a中只含有C、H两种元素
B. 几种元素的原子半径由大到小顺序为Z>Y>X>W
C. d是离子化合物,阴阳离子个数比为1:2
D. Y与W形成的简单化合物是同主族元素同类型化合物中沸点最低的
查看答案和解析>>
科目: 来源: 题型:
【题目】已知高锰酸钾与浓盐酸在常温下反应能产生氯气。若用下图所示的实验装置来制备纯净、干燥的氯气,并实验其与金属的反应。每个虚线框表示一个单元装置,其中有错误的是( )
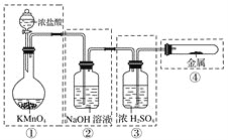
A.①和②处B.只有②处
C.②和③处D.②、③、④处
查看答案和解析>>
科目: 来源: 题型:
【题目】一种新型的“锂-呼吸CO2电池”,结构如图所示,下列说法不正确的是
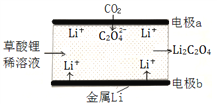
A. 该装置是化学能转变为电能
B. 利用该技术可减少温室气体CO2的排放
C. 正极的电极反应为:2CO2 + 2e- = C2O42-
D. 每生成10.2g Li2C2O4,有0.2mol Li+从正极迁移至负极
【答案】D
【解析】A、该装置为原电池装置,将化学能转化为电能,故A正确;B、由图可知,CO2转化为C2O42-,可减少温室气体的排放,故B正确;C、CO2→C2O42-,碳元素化合价降低,得电子,则CO2在正极发生反应,电极反应为:2CO2 +2e-=C2O42-,故C正确;D、原电池中,阳离子向正极移动,故D错误。故选D。
【题型】单选题
【结束】
27
【题目】用惰性电极电解足量下列溶液一段时间后,再加入一定量括号内的纯净物,能使溶液恢复到原来的成分和浓度的是
A. AgNO3[AgNO3] B. NaOH[NaOH] C. KCl[H2O] D. CuSO4[CuO]
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下列各组物质:①金刚石和石墨,②H、D和T,③苯和乙苯,④CH3(CH2)2CH3,和(CH3)2CHCH3中,互为同位素的是(填序号,下同)________,互为同素异形体的是_________,互为同系物的是________,属于同分异构体的是______________________。
(2)现有CH4、C2H6、C2H4、C3H6、C6H6五种有机物,质量相同时,完全燃烧消耗O2的量最多的是_______(填分子式,下同),完全燃烧所生成的CO2最多的是________,生成的水最多的是________;120 ℃,101 kPa下,将上述五种有机物分别与足量的空气混合,引燃反应后恢复到原来的状态,气体体积不变的是________与_____________。
(3)两种气态烃组成的混合物6.72L(标准状况),完全燃烧生成0.48molCO2和10.8gH2O,则该混合烃中一定含有____(化学式),若另一种烃一定条件下最多能与等物质的量的H2完全加成,则该烃的名称为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】织物漂白剂亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO![]() 、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。25 ℃时,各组分含量随pH变化情况如图所示(Cl-没有画出)。下列说法错误的是
、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。25 ℃时,各组分含量随pH变化情况如图所示(Cl-没有画出)。下列说法错误的是

A. 25 ℃时,HClO2的电离平衡常数的数值Ka=10-6
B. 使用该漂白剂的最佳pH为3.0
C. 25 ℃时,等浓度的HClO2溶液和NaClO2溶液等体积混合后,混合溶液中:c(HClO2)+2c(H+)=c(ClO![]() )+2c(OH-)
)+2c(OH-)
D. 该温度下的NaClO2溶液中c(Na+)>c(ClO![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】用![]() 表示阿伏加德罗常数的数值,下列说法中正确的是
表示阿伏加德罗常数的数值,下列说法中正确的是
A. 在常温常压下,11.2L氯气所含的原子数为![]()
B. 2.3g金属钠被氧化成Na2O2,转移电子数为0.1![]()
C. 5.6g铁与足量稀盐酸反应转移的电子数为0.3![]()
D. 2L 0.1 mol/LNa2SO4溶液中含有的Na+的数为0.2![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】I、钢铁中加入少量镍铬等元素可制成不锈钢,东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是______________________。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为_________,提供孤电子对的成键原子是________。
(2)铁元素有变价,试根据原子核外电子排布所遵循的原理解释Fe2+具有较强的还原性,易被氧化为Fe3+的原因______________________________。
(3)普鲁士蓝(Prussian Blue),即亚铁氰化铁,化学式Fe4[Fe(CN)6]3是一种配合物,其中含有的化学键有____________________;
a.共价键 b.离子键 c.配位键 d.金属键 e.氢键
II、钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为2Mn2++5S2O82+8H2O=2MnO4+10SO42+16H+
(4)写出基态锰原子的价电子排布的轨道表示式:________________。
(5)已知H2S2O8的结构如图:
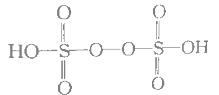
①H2S2O8硫原子的轨道杂化方式为________________。
②上述反应每生成2 mol MnO4,S2O82断裂的共价键数目为_________。
③上述反应中被还原的元素为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物结构简式为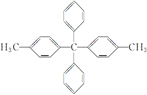 ,对该有机物分子的描述正确的是( )
,对该有机物分子的描述正确的是( )
A. 最多有7个碳原子共线
B. 所有碳原子都在同一平面上
C. 其一氯代物最多有5种
D. 最多有25个原子共面
查看答案和解析>>
科目: 来源: 题型:
【题目】在100 ℃、常压下,将乙醇变为蒸气,然后与乙烯以任意比例混合,混合气体的体积为V L。使该混合气体完全燃烧,需消耗相同条件下的氧气的体积是
A. 2V L B. 2.5V L C. 3V L D. 无法计算
查看答案和解析>>
科目: 来源: 题型:
【题目】氮的单质及一些化合物在工农业生产等领域有重要应用,回答下列问题
(1)羟胺 ( 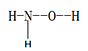 ) 是不稳定的白色大片状或针状结晶。极易吸潮,极易溶于水。
) 是不稳定的白色大片状或针状结晶。极易吸潮,极易溶于水。
①羟胺分子中采用sp3杂化的原子是____________________;羟胺极易溶于水,主要原因是________________________________。
②在羟胺的组成的元素中,处于同一周期元素的第四电离能(I4)较大的是______________(用元素符号表示)。
(2) 吡啶![]() 和邻啡罗啉都是含氮的有机物,l mol吡啶中含有
和邻啡罗啉都是含氮的有机物,l mol吡啶中含有![]() 键的物质的量为_________ mol。
键的物质的量为_________ mol。
(3)已知:每1mol下列物质分解为气态基态原子消耗能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
①NO2 + CO ![]() CO2 + NO
CO2 + NO
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol
2NO(g) ΔH=+179.5 kJ/mol
③2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol
2NO2(g) ΔH=-112.3 kJ/mol
试写出NO与CO反应生成无污染物气体的热化学方程式_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com