
科目: 来源: 题型:
【题目】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)E元素形成的氧化物对应的水化物的化学式为_______________________________。
(2)元素C、D、E形成的简单离子半径大小关系是____________(用离子符号表示)。
(3)用电子式表示化合物D2C的形成过程:_________________。C、D还可形成化合物D2C2,D2C2中含有的化学键类型是_______________________________________________。
(4)由A、B、C三种元素形成的离子化合物的化学式为__________________,它与强碱溶液共热,发生反应的离子方程式是______________________。
(5)某一反应体系中含有D2E、D2EC3、D2EC4三种物质,若此反应为分解反应,则此反应的化学方程式为________________________(化学式用具体的元素符号表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知一个碳原子连两个—OH的结构不稳定,会很快脱去一分子水,其变化如下:
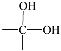 →
→ ![]() + H2O
+ H2O
下图中B和![]() 、
、![]() 等都是A和Cl2发生反应生成的产物,E是一种高分子化合物,透光性能好,常用作一些灯饰外壳。过程中一些小分子都已经略去。
等都是A和Cl2发生反应生成的产物,E是一种高分子化合物,透光性能好,常用作一些灯饰外壳。过程中一些小分子都已经略去。
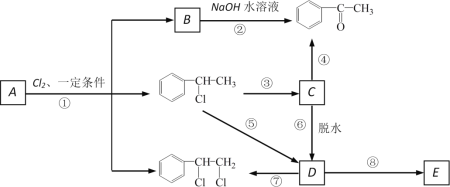
(1)A的化学名称为_____________
(2)第⑦步的化学方程式为___________________________,该反应类型为_____;
(3)E的结构简式为______;
(4)符合下列条件:苯环上有两个取代基且苯环上只有两种不同化学环境的氢的C的同分异构体的结构简式分别是_______________、_____________、________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碘具有多种放射性同位素。![]() I俗称“碘131”,广泛地用于医学诊断,作为追踪剂和甲状腺内分泌失调症的治疗。下列有关
I俗称“碘131”,广泛地用于医学诊断,作为追踪剂和甲状腺内分泌失调症的治疗。下列有关![]() I叙述正确的是( )
I叙述正确的是( )
A.碘元素的相对原子质量为131
B.![]() I是一种新发现的碘的核素
I是一种新发现的碘的核素
C.![]() I位于元素周期表中第四周期ⅦA族
I位于元素周期表中第四周期ⅦA族
D.![]() I核内的中子数与核外电子数之差为29
I核内的中子数与核外电子数之差为29
查看答案和解析>>
科目: 来源: 题型:
【题目】乙烯是一种重要的化工原料,以乙烯为原料生产部分化工产品的反应如下(部分反应条件已略去):
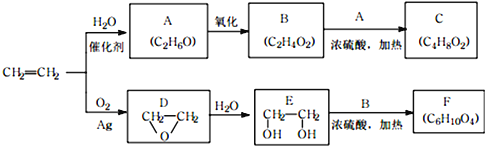
请回答下列问题:
(1)A的名称是___________,含有的官能团名称是_______________。
实验室由A转化为乙烯的反应条件为_______________。
(2)B和A反应生成C的化学方程式为_______________,该反应的类型为_______________。
(3)F的结构简式为__________________。
(4)写出D的同分异构体的结构简式__________________。
(5)乙炔是常见的一种化工原料,它可以制取很多化工产品。例如:聚氯乙烯塑料。写出由乙炔合成聚氯乙烯的合成路线。_____________
(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上烟气脱氮的原理![]()
(1)该反应化学平衡常数K的表达式为____________。温度升高,K值___________(选填“增大”、“减小”、“不变”)。如果平衡常数K值增大,对_______(填“正反应”或“逆反应”)的速率影响更大。
(2)若反应在恒容条件下进行,能说明反应已经达到平衡状态的是______(填序号)
a.容器内混合物的质量不变 b.容器内气体的压强不变
c.反应消耗0.5mol NO的同时生成1mol N2 d.![]() 的浓度不变
的浓度不变
(3)向2 L密闭容器中加入反应物,10 min后达到平衡,测得平衡时气体的物质的量增加了0.2mol,则用![]() 表示的平均反应速率为__________。
表示的平均反应速率为__________。
(4)如图是P1压强下NO的转化率随反应时间(t)的变化图,请在图中画出其他条件不变情况下,压强为![]() 下NO的转化率随反应时间变化的示意图。
下NO的转化率随反应时间变化的示意图。
 ______
______
(5)工业合成氨的反应温度选择500℃左右的原因是_______________。
(6)写出反应物中的氨气的电子式______;其空间构型为______;它常用来生产化肥![]() 。
。![]() 溶液显__________性;常温下将等体积等浓度的氨水和
溶液显__________性;常温下将等体积等浓度的氨水和![]() 溶液混合,pH>7,溶液中
溶液混合,pH>7,溶液中![]() 浓度由大到小的关系是_______________。
浓度由大到小的关系是_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素X、Y、Z、W原子序数依次增大。X氢化物的水溶性显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料,也是一种半导体材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中。请回答:
(1)Y在元素周期表中的位置是________。
(2)Y的最高氧化物相应水化物具有______(填“酸性”、“碱性”、“两性”)。并写出其电离方程式______。
(3)X氢化物的水溶液与W氢化物的水溶液混合后恰好反应时,溶液呈__性(填“酸”、“碱”或“中”),用离子方程式表示其原因是__。
(4)Z和W比较,非金属性较弱的是_______(填元素符号)。下列可以验证这一结论的是_______(填序号)。
a.元素在地壳中的含量
b.最高价氧化物对应水化物的酸性
c.氢化物的水溶性
d.Z与W以共价键形成化合物时,Z或W显示的化合价
查看答案和解析>>
科目: 来源: 题型:
【题目】孔雀石主要含Cu2(OH)2CO3以及少量Fe、Si的化合物。可以用孔雀石为原料制备胆矾(CuSO4·5H2O) 步骤如下:
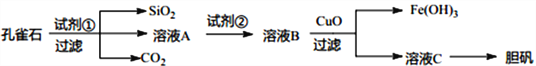
请回答下列问题:
(1)试剂①是一种常见的酸,写出其化学式__________。过滤所需要的玻璃仪器有__________。
(2)实验室检验Fe3+的常用方法是________________。
(3)溶液A中的金属离子有Cu2+、Fe2+、Fe3+上述流程中需要用试剂②将溶液A中的Fe2+全部转化为Fe3+,从而形成溶液B,则试剂②能否用氯水________________(填“能”或“不能”若“不能”,请解释原因)。
(4)由溶液C获得胆矾,需要经过________、__________、过滤等操作。
(5)取25.00mL溶液A,用1.000×10-2mol/LKMnO4标准溶液滴定。反应离子方程式为:5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O,若消耗标准溶液20.00mL,则溶液A中Fe2+的浓度为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知图是由常见元素组成的一些单质及其化合物之间的转化关系图。A是由单质C在D中燃烧生成的淡黄色固体。B是最常见的无色液体,常温常压下,D、F、K均为无色无刺激性气味的气体。H和I焰色反应均为黄色。(反应中生成的部分物质已略去)请回答下列问题:
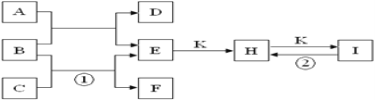
(1)物质A的化学式为____________________。
(2)反应①的离子方程式为_________________________________________。
(3)反应②的化学方程式为__________________________________________。
(4)加热10g H和I的混合物质至质量不再变化,剩余固体质量8.45g,原混合物中H的质量分数为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是苯和溴的取代反应的实验装置图,其中A为具有支管的试管改制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量的铁屑粉。填写下列空白:

(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中发生反应的化学方程式(有机物写结构简式)______________;
(2)试管C中苯的作用是______________。反应开始后,观察D和E两支试管,看到的现象分别是______________,_____________;
(3)反应2 min~3 min后,在B中的氢氧化钠溶液里可观察到的现象是____________;
(4)苯是一种重要的化工原料,以下是用苯作为原料制备某些化合物的转化关系图:
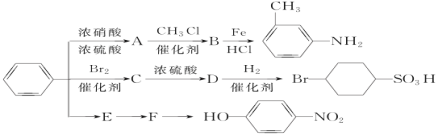
已知:a.RNO2 ![]() RNH2
RNH2
b.苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。
c.![]()
①A转化为B的化学方程式是____________________;
②在“苯![]() E
E![]() F
F![]()
![]() ”的反应中所选试剂a是__________,b是___________,c是__________。
”的反应中所选试剂a是__________,b是___________,c是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃和101kPa时,乙烷、乙炔和丙烯组成的混合烃20mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了40mL,原混合烃中乙炔的体积分数为 ( )
A. 12.5%B. 25%C. 50%D. 75%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com