
科目: 来源: 题型:
【题目】如图表示组成细胞的元素、化合物及其作用,a、b、c、d代表小分子物质,A、B、C代表大分子物质,下列叙述正确的有 ( )。
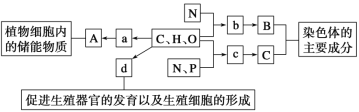
①物质A是淀粉和纤维素,在动物细胞内与其具有相似功能的物质是糖原
②物质a、b、c分别为葡萄糖、氨基酸、脱氧核糖
③物质d进入细胞时不需要消耗ATP,也不需要载体的协助
④若构成两个大分子物质B的小分子物质b的种类和数量相同,则这两个大分子物质B一定相同
A. 0项B. 1项C. 2项D. 3项
查看答案和解析>>
科目: 来源: 题型:
【题目】某可逆反应在某体积为5L的密闭容器中进行,在从0~3分钟各物质的量的变化情况如图所示(A、B、C均为气体)。
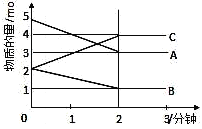
(1)该反应的的化学方程式为______________;
(2)反应开始至2分钟时,B的平均反应速率为______________;
查看答案和解析>>
科目: 来源: 题型:
【题目】在A、B两个恒容密闭容器中发生反应:2NO2![]() 2NO +O2反应过程中NO2的物质的量随时间变化的状况如图所示。
2NO +O2反应过程中NO2的物质的量随时间变化的状况如图所示。
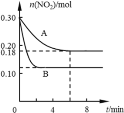
(1)若A容器的体积为5 L,反应经6 min达到平衡状态。0~6 min内用O2浓度变化表示的反应速率为___________________。
(2)写出该反应的化学平衡常数K的表达式:______________________。
(3)说明该反应已达到平衡状态的是_______。
a.v正(NO2)=v逆(NO) b.c(NO2)= c(NO)
c.气体的平均摩尔质量不变 d.气体的密度保持不变
(4)若A、B两容器中只有一个反应条件不同(温度),比较下列物理量。(填“>”、“=”或“<”)
温度 | 反应速率 | 反应的平衡常数 | 反应的热效应(△H) |
TA____TB | vA____vB | KA____KB | △H ____0 |
(5)任写两种能提高二氧化氮转化率的措施_________________、___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)完成下列反应的化学方程式:(注明反应的条件,并配平方程式)
①实验室制乙炔:_________
②向苯酚钠溶液中通入二氧化碳气体:________
③甲苯与氯气在光照条件下反应生成一氯取代产物:___
(2)有机物A的结构简式为
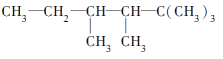
①若A是单烯烃与氢气加成后的产物,则该单烯烃可能有____种结构(不考虑立体异构);
②若A是炔烃与氢气加成后的产物,则此炔烃可能有____种结构;
③若A的一种同分异构体只能由一种烯烃加氢得到,且该烯烃是一个非常对称的分子构型,有顺、反两种结构。
写出A的该种同分异构体(包括顺反异构)的结构简式______、_____;
(3)C5H12O的同分异构体有____种,其中属于醇类且能被氧化成醛的有____种,能消去H2O生成烯的醇有_____种。
查看答案和解析>>
科目: 来源: 题型:
【题目】请参照元素①-⑧在表中的位置,根据判断出的元素回答问题:
① | |||||||
② | ③ | ④ | |||||
⑤ | ⑥ | ⑦ | ⑧ |
(1)⑧原子的最外层电子的轨道表达式为___________________,关于它的最外层p亚层电子的说法错误的是_________。(填序号)
a. 能量相同 b.电子云形状相同
c. 自旋方向相同 d. 电子云伸展方向相同
(2)③和①组成的四核分子的化学式为___________,空间构型为_____________,属于_____分子(填“极性”或“非极性”)。
(3)比较④、⑤元素常见离子的半径大小(用化学式表示)______>_____;②、③ 两元素非金属性较强的是 ______(写元素符号),写出证明该结论的一个事实:___________________________ 。
(4)④、⑤元素形成的四原子化合物的电子式为 ___________ ;已知⑥元素的氧化物的熔点为2054℃,且以它为原料,可以通过电解的方法得到铝,据此推断⑥元素的氧化物为_________晶体(填“分子晶体”或“离子晶体”或“原子晶体”或“金属晶体”)。⑥元素的氧化物熔点______⑥元素的氯化物熔点(填“大于”“小于”“等于”),请解释其原因______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:


可能用到的有关数据如下:
相对分子质量 | 密度/g·cm-3 | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
合成反应:
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 ℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是________。
(2)加入碎瓷片的作用是_____________________________________________________;
如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填字母,下同)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为____________________________________。
(4)分液漏斗在使用前须清洗干净并_____;在本实验分离过程中,产物应该从分液漏斗的_____(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是______________________________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有________。
A.接收器 B.温度计 C.吸滤瓶 D.球形冷凝管
(7)本实验所得到的环己烯产率是________。
A.41% B.50% C.61% D.70%
查看答案和解析>>
科目: 来源: 题型:
【题目】恒容密闭容器中存在下列平衡:![]() 。
。![]() 的平衡物质的量浓度与温度T的关系如图所示。则说法错误的是
的平衡物质的量浓度与温度T的关系如图所示。则说法错误的是
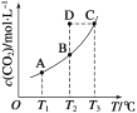
A.反应![]() 为吸热反应
为吸热反应
B.在![]() 时,若反应处于状态D,则一定有v正>v逆
时,若反应处于状态D,则一定有v正>v逆
C.平衡状态A与C相比,平衡状态A中的c(CO)大
D.若![]() 、
、![]() 时的平衡常数分别为
时的平衡常数分别为![]() ,则
,则![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】将0.1 mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起( )
A. 溶液的pH增大
B. CH3COOH电离度增大
C. 溶液的导电能力减弱
D. 溶液中c(OH-)减小
查看答案和解析>>
科目: 来源: 题型:
【题目】对于反应:![]() (Q>0),达到平衡后,改变一个条件,以下有关分析正确的是
(Q>0),达到平衡后,改变一个条件,以下有关分析正确的是
A.升高温度,正反应速率增大,化学平衡常数增大
B.减小压强,逆反应速率减小,化学平衡常数减小
C.加入催化剂,正逆反应速率不变,平衡不移动
D.充入氧气,正反应速率先增大后减小,平衡向正反应方向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是
A.过氧化钠和水反应:![]()
B.氯化铝的溶液中加入过量氨水:![]()
C.单质铜与稀硝酸反应:![]()
D.向Fe2(SO4)3的酸性溶液中通入足量HI:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com