
科目: 来源: 题型:
【题目】NaOH溶液可用于多种气体的处理.
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3.
①Na2CO3俗称纯碱,因CO32﹣水解而使其水溶液呈碱性,可用于除油污,写出CO32﹣水解的离子方程式_______________________。
②泡沫灭火器中通常装有NaHCO3溶液和Al2(SO4)3溶液,请写出这两种溶液混合时的离子反应方程式_______________________。
(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式为:2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2molNaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.lmolL﹣1CH3COONa溶液,则两份溶液中
c(NO3﹣)、c(NO2﹣)和c(CH3COO﹣)由大到小的顺序为_____(已知HNO2的电离常数Ka=7.1×10﹣4molL﹣1,CH3COOH的电离常数Ka=1.7×10﹣5molL﹣1)。可使溶液A和溶液B的 pH相等的方法是___。
A 向溶液A中加适量NaOH B 向溶液A中加适量水
C 向溶液B中加适量NaOH D 向溶液B中加适量水
(3)烟气中的SO2会引起酸雨,可利用氢氧化钠溶液吸收。吸收SO2的过裎中,溶液中H2SO3、HSO3﹣、SO32﹣三者所占物质的量分数(a)随pH变化的关系如图所示:

①图中pH=7时,溶液中离子浓度关系正确的是______。
A.c(Na+)>2c(SO32-)>c(HSO3-)
B.c(Na+)=c(SO32﹣) +c(HSO3﹣)+c(H2SO3)
C.c(OH﹣)=c(H+)+c(H2SO3)+c(HSO3﹣)
D.c(Na+)>c(HSO3﹣)>c(SO32﹣)> c(H+)=c(OH﹣)
②利用如图中数据,求H2SO3![]() H++ HSO3﹣的平衡常数的数值_____(保留两位小数)。
H++ HSO3﹣的平衡常数的数值_____(保留两位小数)。
查看答案和解析>>
科目: 来源: 题型:
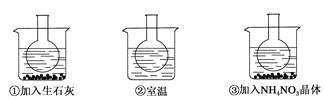
【题目】如图所示三个烧瓶中分别装入含酚酞的0.01 mol·L-1 CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰;向烧杯③中加入NH4NO3晶体;烧杯②中不加任何物质。
(1)含酚酞的0.01 mol·L-1 CH3COONa溶液显浅红色的原因为________(请写出相应的离子方程式和必要的文字说明)。
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是_____。
A.水解反应为放热反应 B.水解反应为吸热反应
C.NH4NO3溶于水时放出热量 D.NH4NO3溶于水时吸收热量
(3)向0.01 mol·L-1 CH3COONa溶液中分别加入少量浓盐酸、NaOH固体、Na2CO3固体、FeSO4固体,使CH3COO-水解平衡移动的方向分别为____、___、____、____(填“左”“右”或“不移动”)。
(4)已知室温时,CH3COOH电离常数为1.75×10-5,NH3·H2O电离常数为1.75×10-5。浓度均为0.1 mol·L-1的下列溶液:①CH3COONa、②NH4Cl、③CH3COONH4、④(NH4)2SO4,pH由小到大排列的正确顺序为 ____。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.某微粒的结构示意图为![]() ,试回答:
,试回答:
(1)当y=8时,该粒子可能是_____、_____(分别写出一种阳离子和一种阴离子)。
(2)当x-y=10时,该粒子为_______(选填“原子”或“阳离子”、“阴离子”)。
(3)请写出工业上制取y=7元素对应单质的化学方程式:________________。
Ⅱ.现有 ①BaCl2晶体 ②金刚石 ③碘片 ④干冰 ⑤二氧化硅 ⑥氢氧化钾 ⑦钠 七种物质,请按下列要求回答(填序号):
(1)属于只含离子键的离子晶体的是____________(填序号,下同)。
(2)属于分子晶体的单质是__________。
(3)属于原子晶体的化合物是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】合理利用资源,加强环境保护,降低碳的排放,实施低碳经济是今后经济生活主流。
(1)下列措施不利于有效减少二氧化碳排放的是___。
A.植树造林,保护森林,保护植被
B.加大对煤和石油的开采,并鼓励使用石油液化气
C.大力发展风能、水力、潮汐能发电和核电,大力推行太阳能的综合开发
D.推广使用节能灯和节能电器,使用空调时夏季温度不宜设置过低,冬天不宜过高
E.倡导出行时多步行和骑自行车,建设现代物流信息系统,减少运输工具空驶率
(2)科学家致力于二氧化碳的“组合转化”技术研究,如将CO2和H2以1∶4比例混合通入反应器,在适当条件下反应可获得一种重要能源。请完成以下化学方程式:
CO2+4H2![]() ______+2H2O。
______+2H2O。
(3)CO2合成生产燃料甲醇(CH3OH)是碳减排的新方向。现进行如下实验:某温度下在体积为1 L的密闭容器中,充入2 mol CO2和6 mol H2,发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)能判断该反应已达化学反应限度的标志是____(填字母)。
CH3OH(g)+H2O(g)能判断该反应已达化学反应限度的标志是____(填字母)。
A.CO2百分含量保持不变
B.容器中H2浓度与CO2浓度之比为3:1
C.容器中混合气体的质量保持不变
D.CO2的生成速率与CH3OH的生成速率相等
现测得CO2和CH3OH(g)的浓度随时间变化如图所示。
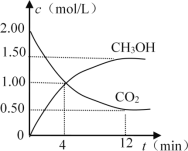
从反应开始到平衡,氢气的平均反应速率v(H2)= _____mol/(L·min)。
(4)以KOH为电解质的甲醇燃料电池总反应为:2CH3OH+3O2+4KOH = 2K2CO3+6H2O,通入甲醇的电极为燃料电池的___极,正极发生的电极反应式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】将64 g铜放入300 mL某浓度硝酸中,当铜反应完全时,共收集到标准状况下NO、NO2混合气体22.4 L,下列说法正确的是
A.硝酸在反应中只表现为强氧化性B.参加反应硝酸的物质的量为3 mol
C.在反应过程中转移的电子数为3NAD.原硝酸的浓度一定为10 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下存在反应:2SO2(g) + O2(g) ![]() 2SO3(g),Δ H<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如如图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是
2SO3(g),Δ H<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如如图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是

A. 容器I、III中平衡常数相同
B. 容器II、III中正反应速率相同
C. 容器II、III中的反应达平衡时,SO3的体积分数:II>III
D. 容器I中SO2的转化率与容器II中SO3的转化率之和小于1
查看答案和解析>>
科目: 来源: 题型:
【题目】关于下列各装置图的叙述中,正确的是
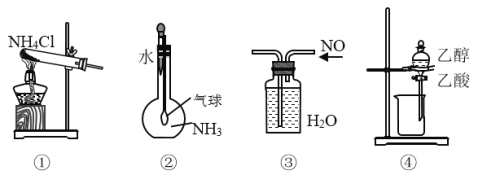
A.实验室用装置①制取氨气B.装置②用于证明氨气极易溶于水
C.装置③用于排水集气法收集NOD.装置④用于分离乙酸与乙醇
查看答案和解析>>
科目: 来源: 题型:
【题目】碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用。
(1)真空碳热还原![]() 氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
2Al2O3(s)+2AlCl3(g)+6C(s)=6AlCl(g)+6CO(g)△H=akJmol-1
3AlCl(g)=2Al(l)+AlCl3(g)△H=bkJmol-1
反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=________ kJmol-1用含a、b的代数式表示![]() ;
;
(2)用活性炭还原法可以处理氮氧化物![]() 某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)N2(g)+CO2(g)△H=QkJmol-1在T1℃时,反应进行到不同时间测得各物质的浓度如下:
某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)N2(g)+CO2(g)△H=QkJmol-1在T1℃时,反应进行到不同时间测得各物质的浓度如下:
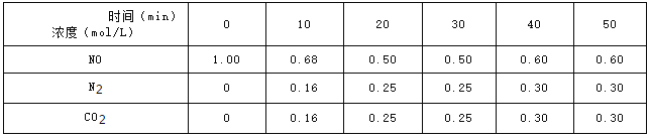 ①
①![]() 内,NO的平均反应速率
内,NO的平均反应速率![]() _________,
_________,![]() 时,该反应的平衡常数
时,该反应的平衡常数![]() _________;
_________;
②30min 后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 ___________ ![]() 填字母编号
填字母编号![]() .
.
![]() 通入一定量的NO b.加入一定量的活性炭
通入一定量的NO b.加入一定量的活性炭
![]() 加入合适的催化剂
加入合适的催化剂 ![]() 适当缩小容器的体积
适当缩小容器的体积
③若30min后升高温度至![]() ,达到平衡时,容器中NO、N2、CO2的浓度之比为3∶1∶1,则Q____________
,达到平衡时,容器中NO、N2、CO2的浓度之比为3∶1∶1,则Q____________![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() .
.
④在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 ________填选项编号
![]() .
.
![]() 单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g)
单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g)
b.反应体系的温度不再发生改变
![]() 混合气体的密度不再发生改变
混合气体的密度不再发生改变
![]() 反应体系的压强不再发生改变
反应体系的压强不再发生改变
(3)铝电池性能优越,Al-Ag2O电池可用作水下动力电源,其原理如图所示:
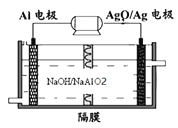
请写出该电池正极反应式__________常温下,用该化学电源和惰性电极电解300mL硫酸铜溶液(过量),消耗27mgAl,则电解后溶液的![]() ___________
___________![]() 不考虑溶液体积的变化
不考虑溶液体积的变化![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为铜锌原电池示意图,下列关于锌铜原电池的说法正确的是( )

A. 负极发生的反应是:2H+ +2e—=H2↑
B. 溶液中SO42-向铜片的方向移动
C. 该装置实现了化学能转化为电能
D. 若生成0.2mol H2,则有6.5克锌被还原
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,将0.10 mol·L-1盐酸逐滴滴入20.00 mL 0.10 mol·L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示。已知:pOH= -lg c(OH-)。下列说法正确的是( )
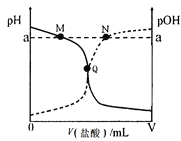
A. M点所示溶液中:c(NH4+)+c(NH3·H2O)= c(Cl-)
B. N点所示溶液中:c(NH4+)>c(Cl-)
C. Q点所示消耗盐酸的体积等于氨水的体积
D. M点和N点所示溶液中水的离子积相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com