
科目: 来源: 题型:
【题目】某兴趣小组探究 SO2 气体还原 Fe3+,他们使用的药品和装置如图所示,下列说法不合理的是( )

A.为了验证 A 中发生了氧化还原反应,加入KMnO4溶液,紫红色褪去
B.为了验证 A 中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀
C.能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
D.装置C的作用是吸收SO2尾气,防止污染空气
查看答案和解析>>
科目: 来源: 题型:
【题目】用下列实验装置进行相应的实验,能够达到实验目的的是( )
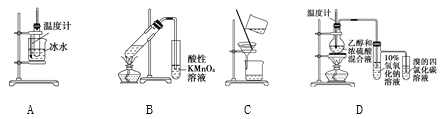
A. 实验室制取少量硝基苯 B. 证明溴乙烷、NaOH、乙醇溶液共热生成乙烯
C. 分离乙酸乙酯、碳酸钠和水的混合物 D. 证明乙醇浓硫酸共热生成乙烯
查看答案和解析>>
科目: 来源: 题型:
【题目】火山爆发时会喷出SO2,SO2是大气主要污染物之一,在工业中可用于制备硫酸。回答下列问题:
(1)SO2是_____(填“电解质”或“非电解质”)。
(2)Cu2S与O2反应可生成SO2,已知:
Cu(s)+![]() O2(g)=CuO(s) △H=x kJmol-1
O2(g)=CuO(s) △H=x kJmol-1
Cu(s)+![]() S(s)=
S(s)=![]() Cu2S(s) △H=y kJmol-1
Cu2S(s) △H=y kJmol-1
S(s)+O2(g)=SO2(g) △H=z kJmol-1
写出Cu2S与O2反应生成CuO和SO2的热化学方程式__________________________。
(3)硫酸工业中涉及反应:2SO2(g)+O2(g)2SO3(g)△H=Q kJ·mol-1。一定条件下,在2L恒容密闭容器中,通入2molSO2和1molO2发生上述反应,SO2的平衡转化率与压强、温度的关系如图所示。a点时此反应的平衡常数的数值为_____。
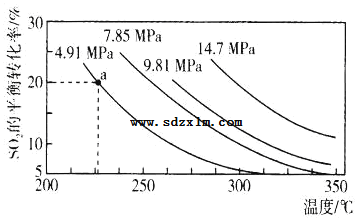
关于该反应,下列说法正确的是____。
A.容器内混合气体的密度不再变化时,反应达到平衡
B.相同时间内生成2molSO2同时消耗1molO2,反应达到平衡
C.Q大于0
D.相同温度下,压强越大,SO2的平衡转化率就越大,该反应的平衡常数就越大
E.反应达到平衡后保持温度不变,再充入2molSO2和1molO2,SO2的平衡转化率增大
F.反应达到平衡后保持温度不变,再充入He(g),SO2的平衡转化率增大
(4)将SO2通入酸化的硝酸钡溶液可生成硫酸钡沉淀,25℃时,KSP(BaSO4)=1×10-10。KSP(BaCO3)=2.6×10-9。该温度下,BaSO4和BaCO3沉淀共存的悬浊液中,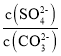 =___。
=___。
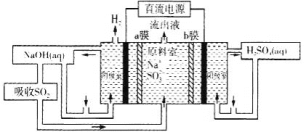
(5)用如图装置回收SO2可制得硫酸,电极为惰性电极,a、b膜分别为阳离子交换膜、阴离子交换膜。阳极的电极反应为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】五氧化二钒(V2O5)在冶金、搪瓷、磁性材料等领域有重要应用。实验室以含钒废料(含V2O3、CuO、MnO、SiO2、A12O3、有机物)为原料制备V2O5的一种流程如图:
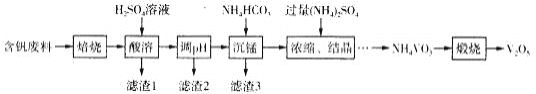
已知I.含钒离子在溶液中的主要存在形式与溶液pH的关系如表所示:

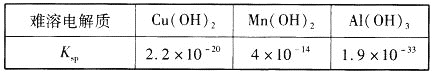
Ⅱ.25℃时,难溶电解质的溶度积常数如表所示:
Ⅲ.NH4VO3在水中的溶解度:20℃、4.8g·L-1;60℃、24.2g·L-1。
回答下列问题:
(1)“焙烧”的目的是_____。
(2)“滤渣1”的用途为____(写出一种即可)。
(3)通过计算说明,常温下,若“调pH”为7,Cu2+是否沉淀完全____。(溶液中离子浓度小于10-5mol·L-1时,认为该离子沉淀完全)
(4)“沉锰”需将温度控制在70℃左右,温度不能过高或过低的原因为____。
(5)结晶所得NH4VO3需进行洗涤、干燥。合适的洗涤试剂为____;证明NH4VO3已洗涤干净的实验操作及现象为____。
(6)“煅烧”时生成两种能参与大气循环的气体,该反应的化学方程式为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下面的反应路线及所给信息填空:
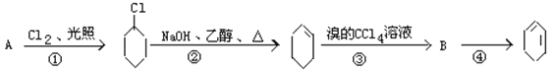
(1)A的结构简式是_____________,名称是_______________________;
(2)①的反应类型______________,②的反应类型__________________;
(3)反应②的化学方程式_______________________________;
反应④的化学方程式______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 用银氨溶液检验乙醛中的醛基:CH3CHO + 2Ag(NH3)2+ +2OH-![]() CH3COONH4 + 3NH3 + 2Ag↓+ H2O
CH3COONH4 + 3NH3 + 2Ag↓+ H2O
B. 苯酚钠溶液中通入少量CO2:CO2+ H2O + 2C6H5O-→ 2C6H5OH + CO32-
C. 氯乙烷中滴入AgNO3溶液检验其中氯元素:Cl-+ Ag+ =AgCl↓
D. 硫酸铝溶液中加入过量的氨水:Al3+ + 3NH3·H2O=Al(OH)3↓ + 3NH4+
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室可以用乙醇和浓硫酸在170℃时制乙烯,化学反应原理为CH3CH2OH![]() CH2=CH2↑+H2O。由于浓硫酸具有强氧化性,故该反应的副产物有二氧化硫和二氧化碳等。某同学根据上述信息和相应的实验目的选择下列实验装置设计。实验(每种装置都有若干个):
CH2=CH2↑+H2O。由于浓硫酸具有强氧化性,故该反应的副产物有二氧化硫和二氧化碳等。某同学根据上述信息和相应的实验目的选择下列实验装置设计。实验(每种装置都有若干个):
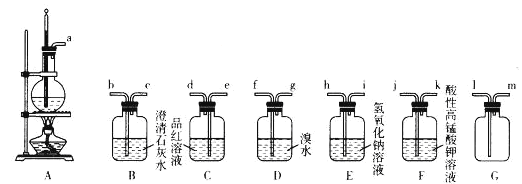
请回答下列问题:
(1)验证乙醇与浓硫酸混合反应产生了二氧化硫和二氧化碳。
①选择必要装置并进行连接:a→_____(填接口序号)。
②确定混合气体中有二氧化碳存在的实验依据是______。
(2)选择装置制备1,2—二溴乙烷。
①该同学设计的方案中装置连接顺序为A→E→D。此方案是否合理?_____(填“合理”或“不合理”);若不合理,请提出改进方案或方法_____。
②分离出1,2—二溴乙烷的操作中使用的玻璃仪器为_____。
③有同学建议在A、E之间增加G装置,其作用是____,a与G装置接口___(填“1”或“m”)连接。
(3)阅读资料知“酸性高锰酸钾溶液能氧化乙烯生成二氧化碳”。
请设计实验方案验证资料的真实性。
①装置连接顺序为A→_____。
②能证明上述资料真实的实验现象是_____。
(4)为了探究乙烯与溴水的反应是取代反应还是加成反应,该同学进行如下实验:①测定D装置中溴水的pH;②将纯净的乙烯通入D装置至溶液褪色;③____。
查看答案和解析>>
科目: 来源: 题型:
【题目】用图所示装置检验乙烯时不需要除杂的是
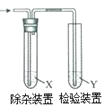
乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为一种天然产物,具有一定的除草功效。下列有关该化合物的说法错误的是

A. 分子中含有三种含氧官能团
B. 1mol该化合物最多能与4molNaOH反应
C. 既可以发生取代反应,又能够发生加成反应
D. 既能与FeCl3发生显色反应,也能和NaHCO3反应放出CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】在常温下,向一定量的0.1molL-1一元碱(BOH)溶液中逐滴加入一定浓度的盐酸。溶液中由水电离出的氢离子浓度的负对数[用pC表示,pC=-lgc水(H+)]与加入盐酸体积的关系如图所示。下列说法错误的是
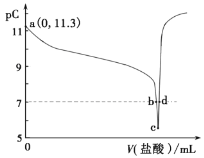
A.该一元碱为弱碱且Kb的数量级为10-5
B.b点溶液呈中性
C.c点到d点的溶液中:c(BOH)+c(OH-)>c(H+)
D.c点溶液中水的电离程度最大,且c(B+)<c(C1-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com