
科目: 来源: 题型:
【题目】根据下列结构示意图,判断下列说法中正确的是

A. 在NaCl晶体中,距Na+最近的多个Cl-构成正四面体
B. 在CaF2晶体中,Ca2+的配位数为4
C. 在金刚石晶体中,碳原子与碳碳键数之比为1:2
D. 该气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.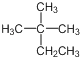 的系统命名为2甲基2乙基丙烷
的系统命名为2甲基2乙基丙烷
B.用酸性KMnO4溶液可以确定CH2=CHCHO中含有C=C双键
C.在酸性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH
D.乙烯和聚氯乙烯都能使溴的四氯化碳溶液褪色
查看答案和解析>>
科目: 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知 W 的一种核素的质量数为 18,中子数为 10;X 和 Ne 的核外电子数相差 1; 在Z所在的周期中,Z 元素的原子得电子能力最强;四种元素的最外层电子数之和为18。 请回答下列问题:
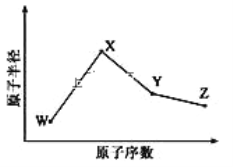
(1)X 元素位于元素周期表中位置为_____________。
(2)X 的单质和 Y 的单质相比,熔点较高的是____________(写化学式) 。 Z 所在族的简单氢化物中,沸点最高的是________(写化学式),原因为_________________________。
(3)W、X、Z 三种元素形成的化合物中化学键类型为________;X2W2的电子式为___________________。
(4)Y 与 Z 形 成的化合物在常温下是一种液态,它和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式为__________________________。
(5)Z 的氧化物很多,其中一种黄绿色气体 M,其氧含量为 47.41%,可用于水处理, M 在液态和浓缩气态时具有爆炸性 。 M 的化学式为_____________。 M 可与 NaOH 溶液反应生成两种稳定的盐,它们的物质的量之比为 1︰5,该反应的化学方程式为___________________。
(6)在 25°C、101kPa 下,已知 Y 的简单气态氢化物在氧气中完全燃烧后恢复至原状态, 平均每转移 1mol 电子放热 190kJ, 该反应的热化学方程式为__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是实验室制取SO2,并验证SO2的某些性质的装置(夹持装置和加热装置已略,气密性已检验)。请回答下列问题:
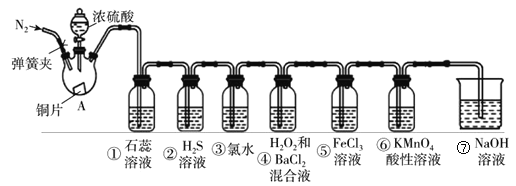
(1)在A中发生反应的化学方程式为:__________。
(2)③中化学反应方程式____,④中产生白色沉淀,离子方程式为________,⑤中的现象见溶液由黄色变为浅绿色,其反应的离子方程式为_________。
(3)能体现出SO2还原性的实验序号是____。
(4)实验结束后需要通入N2,其目的____。
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积为2 L的密闭容器中进行如下反应:A(g)+2B(g)![]() 3C(g)+nD(g),开始时A的物质的量为4 mol,B的物质的量为6 mol;5 min末测得C的物质的量为3 mol,用D表示的化学反应速率v(D)为0.2 mol·L-1·min-1。计算:
3C(g)+nD(g),开始时A的物质的量为4 mol,B的物质的量为6 mol;5 min末测得C的物质的量为3 mol,用D表示的化学反应速率v(D)为0.2 mol·L-1·min-1。计算:
(1)5 min末A的物质的量浓度为________。
(2)前5 min内用B表示的化学反应速率v(B)为_______。
(3)化学方程式中n的值为____。
(4)此反应在四种不同情况下的反应速率分别为
①v(A)=5 mol·L-1·min-1 ②v(B)=6 mol·L-1·min-1
③v(C)=4.5 mol·L-1·min-1 ④v(D)=8 mol·L-1·min-1
其中反应速率最快的是_______(填序号)。
(5)在4 L密闭容器中,X、Y、Z三种气体的物质的量随时间变化曲线如图:

①该反应的化学方程式是___________。
②该反应达到平衡状态的标志是_______(填字母)。
A.Y的体积分数在混合气体中保持不变
B.X、Y的反应速率比为3:1
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
E.生成1 mol Y的同时消耗2 mol Z
③2 min内Y的转化率为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在容积为1L的密闭容器中充入![]() 和
和![]() 发生
发生![]() 测得
测得![]() 的物质的量随时间的变化如图所示,(已知,此温度下,该反应的平衡常数
的物质的量随时间的变化如图所示,(已知,此温度下,该反应的平衡常数![]() )下列说法正确的是 ( )
)下列说法正确的是 ( )
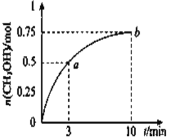
A. ![]()
B. 点b所对应的状态为化学平衡状态
C. ![]() 的生成速率,点a低于点b
的生成速率,点a低于点b
D. 欲增大平衡状态时![]() ,可保持其他条件不变,升高温度
,可保持其他条件不变,升高温度
查看答案和解析>>
科目: 来源: 题型:
【题目】能正确表达下列反应的离子方程式为
A.用醋酸除去水垢:2H++CaCO3![]() Ca2++CO2↑+H2O
Ca2++CO2↑+H2O
B.硫化亚铁与浓硫酸混合加热:2H++FeS![]() H2S↑+Fe2+
H2S↑+Fe2+
C.向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3CO32-![]() Al2(CO3)3↓
Al2(CO3)3↓
D.电解饱和食盐水获取烧碱和氯气:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】一定稳定下,在容积不变的密闭容器中,进行如下可逆反应:![]() ,下列能表明该反应已达到平衡状态的是
,下列能表明该反应已达到平衡状态的是
①![]()
②![]()
③![]()
④混合气的密度保持不变
⑤混合气体的平均摩尔质量不变
A.仅④B.仅④⑤
C.仅①④D.仅③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
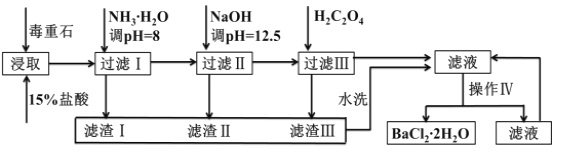
Ca2+ | Mg2+ | Fe3+ | ||
开始沉淀的pH | 11.9 | 9.1 | 1.9 | |
完全沉淀的pH | 13.9 | 11.1 | 3.2 | |
已知:室温条件下BaC2O4和CaC2O4均为沉淀,但BaC2O4的溶解度相对较大
(1)实验室用37%的盐酸配制1mol/L盐酸,下列仪器中,不需要使用的是_____
a.容量瓶 b.量筒 c.烧杯d.滴定管
(2)为了加快毒重石的酸浸速率,可以采取的措施有________________________(至少两条)。
(3)加入氨水调节溶液pH=8的目的是__________________。滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是________________________________。
(4)操作Ⅳ的步骤是:___________、___________、过滤。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法和解释错误的是
A. 冰融化时,需破坏晶体中的全部氢键,所以冰融化时密度变大
B. 卤化物![]() 从F到I,由于分子量增大,分子间范德华力增大,熔沸点也逐渐升高
从F到I,由于分子量增大,分子间范德华力增大,熔沸点也逐渐升高
C. 由于石墨晶体中层间距较远,电子不易实现迁移,所以石墨的导电性只能沿石墨平面的方向
D. 金属中的“电子气”在电场中可以定向移动,所以金属具有良好的导电性。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com