
科目: 来源: 题型:
【题目】下图为实验室制取少量乙酸乙酯的装置图。下列关于该实验的叙述中,不正确的是( )

A. 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸
B. 试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象
C. 实验时加热试管a的目的是加快反应速率并及时将乙酸乙酯蒸出
D. 试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇
查看答案和解析>>
科目: 来源: 题型:
【题目】已知合金A由两种常见的金属组成。为测定其组成,某同学的实验流程如图所示:

请回答:
(1)合金A中的两种金属为_____(填化学式)。
(2)过程②中分离C和E的化学实验基本操作是________。
(3)溶液H中所含的阳离子有_____(用离子符号表示)。
(4)为测定合金的组成,若需要称量沉淀F的质量,则F需要洗涤,证明沉淀F洗涤干净的方法是_____________________。
(5)写出②③及由溶液H和氨水反应生成白色沉淀的离子方程式(没有离子方程式的写化学方程式):
过程②___________________;
______________________;
_______________________。
过程③_______________。
溶液H与氨水:_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化氯(ClO2)是高效安全的饮用水消毒剂,得到越来越广泛的应用。回答下列问题:
I.实验室合成ClO2常用盐酸或双氧水还原氯酸钠(NaClO3)。
(1)盐酸和NaClO3反应时有ClO2和Cl2生成,书写反应的离子方程式并标出电子转移的方向和数目______________________________________,当反应中转移0.2mol电子时,参加反应的还原剂的物质的量为________________________________。
(2)使用双氧水作还原剂的优点是_________________________________________。
II.当pH≤2.0时,NaClO2能被I 完全还原成Cl;(离子反应方程式为ClO2+4H++4I→2I2+Cl+2H2O)。回答下列问题:
溶液中Na2S2O3能与I2反应生成NaI和Na2S4O6(2Na2S2O3+I2→2NaI+Na2S4O6)。欲测定成品中NaClO2的含量,现进行如下操作:
步骤Ⅰ | 称取样品Wg配成溶液置于锥形瓶中,并调节pH≤2.0 |
步骤Ⅱ | 向锥形瓶中加入足量KI晶体,充分搅拌,并加入少量指示剂 |
步骤Ⅲ | 用c mol/L的Na2S2O3溶液滴定发生反应 |
(1)步骤Ⅱ加入指示剂的名称是_______________。滴定终点时溶液的颜色变化为_________。
(2)若上述滴定操作中平均消耗VmL Na2S2O3标准溶液,则成品中NaClO2的质量分数为__________(用含W、c、V的代数式表示)。
(3)ClO2和Cl2均能将电镀废水中的CN 氧化为无毒的物质,自身被还原为Cl,处理含相同量CN的电镀废水,所需Cl2的物质的量是ClO2的___倍。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验装置不能达到实验目的的是
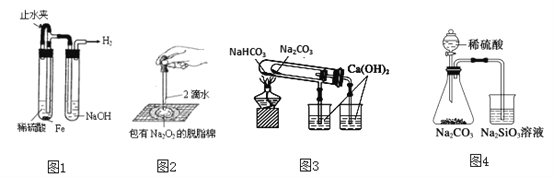
A. 图1:制备并观察氢氧化亚铁
B. 图2:证明过氧化钠与水反应放热
C. 图3:验证NaHCO3和Na2CO3的热稳定性
D. 图4:验证酸性强弱H2SO4>H2CO3>H2SiO3
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车尾气中的主要污染物为NOx、CO等有害物质。目前,已研究出了多种消除汽车尾气污染的方法。
I.催化剂存在时用H2将NO还原为N2。
已知: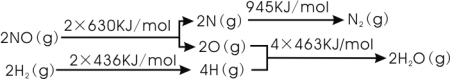
则H2还原NO生成氮气和水蒸气的热化学方程式是:______________________________。
II.用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g)![]() N2(g)+CO2(g)△H=QkJ/mol,在2L恒容密闭器中加入足量的C与NO反应,所得实验数据如表
N2(g)+CO2(g)△H=QkJ/mol,在2L恒容密闭器中加入足量的C与NO反应,所得实验数据如表
实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
(1)写出该反应的平衡常数表达式________________________________________。
(2)结合表中数据,判断该反应的Q___0(填“>”或“<”),理由是________________________。.
(3)用电子式表示产物CO2的形成过程_________________________________________。
(4)判断该反应达到平衡的依据是____________
a.若容器内气体密度恒定,反应达到平衡状态
b.若容器内各气体浓度恒定,反应达到平衡状态
c.若容器内压强恒定,反应达到平衡状态
d.若2υ正(NO)=υ逆(N2),反应达到平衡状态
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液只含有下列离子:NH4+、Na+、Fe2+、NO3-、I、 SO32-、AlO2-中的四种(忽略水的电离),且各离子的物质的量浓度相等,现进行如下实验:
①取少量该溶液加NaOH溶液共热,产生刺激性气味的气体,未观察到其它明显现象;
②取少量该溶液加足量的硝酸,可观察到红棕色气体,未观察到沉淀生成。
根据上述实验,下列说法正确的是()
A.根据实验①只能确定原溶液中一定有![]() ,没有Fe2+
,没有Fe2+
B.取实验②后的溶液滴加淀粉溶液变蓝色
C.原溶液中可能含有NH4+、Na+、SO32-、I四种离子
D.取少量原溶液加酸性高锰酸钾溶液,可能有两种离子被氧化
查看答案和解析>>
科目: 来源: 题型:
【题目】将mg Al2O3、Fe2O3的混和物溶解在过量的100mL0.05 mol/L的硫酸中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好全部转化成沉淀,用去NaOH溶液100mL,则NaOH溶液的浓度为
A. 0.1mol/L B. 0.05mol/L
C. 0.2mol/L D. 无法计算
查看答案和解析>>
科目: 来源: 题型:
【题目】雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-。某同学收集了该地区的雾霾,经必要的预处理后得到试样溶液,设计并完成了如下实验:
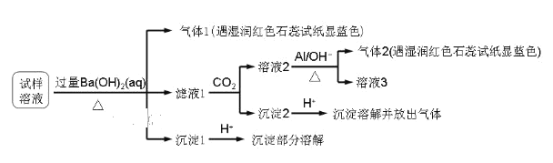
已知:3NO3-+8Al+5OH-+2H2O ![]() 3NH3+8AlO2-
3NH3+8AlO2-
根据以上的实验操作与现象,该同学得出的结论不正确的是( )
A.试样中肯定存在NH4+、Mg2+、SO42-和NO3-
B.该雾霾中可能存在NaNO3、NH4Cl和MgSO4
C.试样中可能存在Na+、Cl-
D.试样中一定不含Al3+
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质中,有顺反异构体的是( )
A. 1,2﹣二氯乙烯ClCH=CHCl
B. 1,1﹣二氯乙烯 Cl2C=CH2
C. 丙烯 CH3﹣CH=CH2
D. 苯乙烯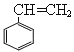
查看答案和解析>>
科目: 来源: 题型:
【题目】乙酰水杨酸是一种常见的解热镇痛药,结构简式如图所示。下列有关叙述正确的是

A.乙酰水杨酸的分子式为C9H10O4
B.乙酰水杨酸的含氧官能团有三种
C.能与NaHCO3溶液反应的官能团有一种
D.烃基(C4H9)取代乙酰水杨酸苯环上的氢原子,最多能形成4种同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com